ในปัจจุบันทั่วโลกมีการบริโภคสุราอย่างกว้างขวาง เฉพาะในประเทศสหรัฐอเมริกาประเทศเดียวประมาณการว่ามีผู้ใหญ่ที่บริโภคสุราสูงถึงร้อยละ 50 และมีประชากรประมาณ 15 ถึง 20 ล้านคนที่ป่วยเป็นโรคพิษสุราเรื้อรัง (alcoholism). นอกจากนี้ร้อยละ 20-40 ของผู้ป่วยที่เข้ารักษาตัวในโรงพยาบาลมีปัญหาที่เกี่ยวข้องกับการบริโภคสุรา พบว่าแอลกอฮอล์สามารถซึมผ่านเนื้อเยื่อและอวัยวะต่างๆ ได้เป็นอย่างดีและส่งผลกระทบต่อการทำงานของอวัยวะต่างๆ โดยเฉพาะการทำงานของตับ. แอลกอฮอล์เป็นสาเหตุสำคัญที่ก่อให้เกิดโรคตับแข็ง ซึ่งเป็นโรคที่มีการดำเนินโรคที่รุนแรงกว่าโรคมะเร็งบางชนิดเสียอีก.1 ในด้านผลของการดื่มแอลกอฮอล์ต่อระบบหัวใจและหลอดเลือด มีข้อมูลว่าสามารถช่วยลดอัตราการตายได้ โดยเฉพาะการดื่มไวน์ แต่ถ้าดื่มในปริมาณที่มากกว่า 50 กรัม/วัน (5-6 แก้วต่อวัน) จะมีผลในทางตรงกันข้าม.2 ในด้านบทบาทของแอลกอฮอล์ต่อการทำงานและการดำเนินโรคทางไต อาจจะไม่ได้เด่นชัดเท่ากับผลกระทบต่อการทำงานของตับหรือในอวัยวะอื่นๆ โดย Bright เป็นผู้ที่ตั้งข้อสังเกตนี้ตั้งแต่เมื่อ 170 ปีที่แล้ว3 หลังจากนั้นข้อมูลการศึกษาบทบาทของแอลกอฮอล์ต่อการทำงานและการดำเนินโรคทางไตเริ่มมีเพิ่มมากขึ้นทั้งในมนุษย์และในสัตว์ทดลอง ดังจะได้กล่าวในบทความนี้.
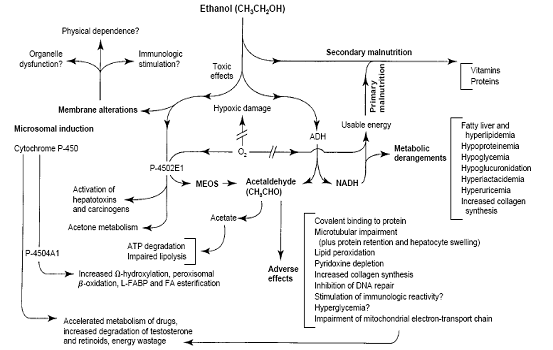
ภาพที่ 1. สารผลลัพธ์จากปฏิกิริยาการสลายแอลกอฮอล.์1
1. ผลกระทบของแอลกอฮอล์ที่มีต่อการทำงานของไต
ไตใช้กระบวนการกรอง (glomerular filtration) และการดูดกลับของท่อไต (tubular reabsorption) ในการควบคุมระดับแอลกอฮอล์ เนื่องจากแอลกอฮอล์เป็นสารที่มีคุณสมบัติในการซึมผ่านสูงทำให้ความเข้มข้นของแอลกอฮอล์ในปัสสาวะและในซีรั่มมีค่าที่ใกล้เคียงกัน
1.1 ผลในแบบเฉียบพลัน (acute effect)
เมื่อทำการวัดการทำงานของ tubular cell โดยวิธีการ micropuncture ไม่พบผลโดยตรงของแอลกอฮอล์ต่อการทำงานของ tubular cell แต่พบว่าสารที่มีผลลดการทำงานของเซลล์เป็นสาร acetaldehyde ซึ่งเป็นเมตาบอไลต์ของแอลกอฮอล์ (ภาพที่ 1) โดยพบว่ามีผลลดการทำงานของ Na+/K+- ATPase ที่บริเวณของ tubular cell4 เนื่องจาก Na+-ATPase pump มีหน้าที่ควบคุมปริมาณโซเดียมและน้ำที่จะเข้าออกเซลล์ จึงมีผลต่อขนาดของเซลล์ด้วย ดังนั้นแอลกอฮอล์จึงส่งผลทำให้ tubular cell มีขนาดใหญ่ขึ้น.5
อย่างไรก็ตามไม่พบว่าแอลกอฮอล์จะมีผลต่ออัตราการกรองของไต (glomerular filtration rate) หรือเลือดที่เข้าไปเลี้ยงไต (renal plasma flow)6 แต่ยังไม่มีข้อมูลเกี่ยวกับผลของแอลกอฮอล์ต่อการเกิดพยาธิสภาพที่ไต.
ที่กล่าวไปแล้วเป็นผลของแอลกอฮอล์ต่อไตโดยตรง ในส่วนผลกระทบโดยอ้อมของแอลกอฮอล์ต่อโรคไตได้แก่การสลายของกล้ามเนื้อ (rhab domyolysis) ซึ่งนำไปสู่ภาวะไตวายเฉียบพลันในที่สุด ภาวะนี้มีการบันทึกไว้ครั้งแรกโดย Hed และคณะ โดยมีปัจจัยส่งเสริมคือการที่มีระดับโพแทสเซียม และฟอสฟอรัสในเลือดที่ต่ำ.7
1.2 ผลในระยะยาว (chronic effect)
ในปัจจุบันยังไม่ทราบกลไกที่แน่ชัดในเรื่องบทบาทของแอลกอฮอล์ต่อการดำเนินโรคไต แต่กลไกที่ได้รับการยอมรับมากที่สุดกลไกหนึ่ง คือการที่แอลกอฮอล์ไปมีผลเพิ่มระดับความดันโลหิต โดยผลจะเห็นได้ชัดในผู้ชายและผู้สูงอายุ8 ในผู้ป่วยที่มีประวัติดื่มสุราในปริมาณมากแล้วเกิดภาวะไตวายฉับพลัน แพทย์ควรสงสัยภาวะ rhabdomyolysis เอาไว้ด้วย.
1.2.1 ข้อมูลในสัตว์ทดลอง
มีข้อมูลทั้งที่กล่าวว่าการดื่มแอลกอฮอล์ มีผลในด้านที่เป็นประโยชน์ และที่เป็นโทษต่อการทำงานของไต Van Thiel DH และคณะ พบว่าการดื่มแอลกอฮอล์เป็นปัจจัยเสี่ยงต่อการเกิดภยันตรายที่โกลเมอรูลัส และทำให้เกิดภาวะ hypertensive nephrosclerosis.9 แต่จากการศึกษาโดย Peter และคณะ ในหนูทดลองที่ทำให้เกิดภาวะไตอักเสบ (glomerulonephritis) และให้ดื่มแอลกอฮอล์เป็นประจำ ไม่พบผลเสียต่อบริเวณ glomerular และ tubulointerstitium, (proteinuria, transforming growth factor ß1 (TGF-ß1), fibronectin และ plasminogen activator inhibitor 1 (PAI 1)).10
นอกจากนั้นมีการศึกษาบทบาทของแอลกอฮอล์ในหนูทดลองที่เป็นโรคไต nephrotic syndrome โดยให้หนูทดลองทำการดื่มแอลกอฮอล์เป็นระยะเวลา 6 สัปดาห์ พบว่าหนูทดลองที่ได้รับแอลกอฮอล์มีการลดลงของปริมาณ proteinuria และโคเลสเตอรอล และมีระดับ albumin ในเลือดที่สูงขึ้นด้วย.11
1.2.2 ข้อมูลในมนุษย์
Perneger และคณะ ได้ทำการศึกษาย้อนหลังเรื่องผลของการดื่มแอลกอฮอล์ต่อการเกิดภาวะไตวายเรื้อรังระยะสุดท้าย ในผู้ป่วยไตวายเรื้อรังระยะสุดท้าย 716 ราย โดยใช้แบบสอบถามที่ดัดแปลง ของ National Health Interview Survey พบว่าการดื่มแอลกอฮอล์ที่มากกว่า 2 แก้วต่อวันมีผลเพิ่มความเสี่ยงต่อการเกิดภาวะไตวายเรื้อรังระยะสุดท้าย ถึงประมาณ 4 เท่า3 (ภาพที่ 2). อย่างไรก็ตาม การศึกษาในระยะต่อมา โดย Knight และคณะ ในพยาบาล 1,658 คนที่มีสุขภาพแข็งแรง ติดตามไปในระยะเวลา 11 ปี ไม่พบว่าการดื่มแอลกอฮอล์ในปริมาณปานกลาง (น้อยกว่า 2 แก้ว/วัน) จะมีผลในการลดการทำงานของไตเมื่อดูผลของค่า glomerular filtration rate (MDRD formula) และค่า creatinine clearance (CCr).12
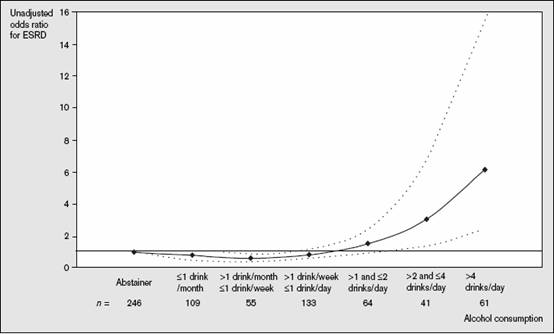
ภาพที่ 2. แสดงผลของการดื่มแอลกอฮอล์ต่อการเกิดภาวะไตวายเรื้อรังระยะสุดท้าย
จำแนกตามปริมาณแอลกอฮอล์ที่ดื่มในแต่ละวันซึ่งมีลักษณะเป็น J curve.3
เช่นเดียวกับการศึกษาของ Schaeffner และคณะ ในผู้ชายที่มีสุขภาพแข็งแรงดี 11,203 คนติดตามไป 11 ปี ไม่พบว่าการดื่มแอลกอฮอล์จะมีผลในการลดการทำงานของไต (glomerular filtration rate) และผลจะดูเหมือนไปในทางด้านตรงข้ามมากกว่า.13
จะเห็นได้ว่าจากข้อมูลการศึกษาบทบาทของแอลกอฮอล์ต่อการดำเนินโรคไต จะมีทั้งข้อมูลทั้งด้านดีและด้านเสีย คงจำเป็นจะต้องรอการศึกษาที่มากขึ้นก่อนที่จะสรุปว่าการดื่มแอลกอฮอล์มีผลต่อการดำเนินโรคไตเป็นอย่างไร.
ที่กล่าวมานั้นเป็นข้อมูลโดยตรงที่แอลกอฮอล์มีผลต่อไต แต่ผลทางอ้อมที่สำคัญอีกภาวะหนึ่ง คือภาวะ hepatorenal syndrome ซึ่งเป็นภาวะที่มีการทำงานลดลงของไต แต่เมื่อไปตรวจพยาธิสภาพไตพบว่าอยู่ในเกณฑ์ปกติ และเมื่อทำการผ่าตัดปลูกถ่ายตับ ไตก็สามารถกลับมาทำงานได้ปกติ พบภาวะนี้ได้ในผู้ป่วยที่มีตับแข็งระยะสุดท้าย เช่นใน advance alcoholic cirrhosis หรือในกรณีที่มีตับวายเฉียบพลันอย่างรุนแรง จะมีการหดตัวของหลอดเลือดแดงที่วิ่งเข้าสู่ไต (renal vasoconstriction) แต่มีการขยายตัวของหลอดเลือดแดงทั่วร่างกาย (systemic arterial vasodilatation) เนื่องมาจากมีการเพิ่มขึ้นของ สารขยายหลอดเลือด (nitric oxide) ในปัจจุบันยังไม่มียาที่มีประสิทธิภาพและราคาถูกเพื่อใช้รักษาภาวะนี้ ดังนั้นควรป้องกันการเกิดตับแข็งโดยการหลีกเลี่ยงการดื่มแอลกอฮอล์.
2. ผลกระทบของแอลกอฮอล์ที่มีต่อสมดุลเกลือแร่และกรดด่างของร่างกาย
2.1 ผลกระทบของแอลกอฮอล์ที่มีต่อสมดุลเกลือแร่
แอลกอฮอล์สามารถเพิ่มปริมาณปัสสาวะ (diuretic effect) โดยการกดการหลั่งสาร antidiuretic hormone (ADH) ซึ่งผลดังกล่าวเกิดขึ้นในขณะที่ระดับสารแอลกอฮอล์ในเลือดเพิ่มขึ้น แต่ในทางตรงข้ามเมื่อระดับแอลกอฮอล์ในเลือดเริ่มลดลงปริมาณปัสสาวะจะลดลง มีการดูดโซเดียมกลับที่ tubular cell เพิ่มขึ้น ผลโดยรวมกลับพบว่าการดื่มแอลกอฮอล์ปริมาณมากๆ เป็นระยะเวลานานๆมีผลให้ลดปริมาณปัสสาวะและเพิ่มปริมาณน้ำของร่างกาย นอกจากนี้แล้วยังพบว่าแอลกอฮอล์ยังสามารถกระตุ้นระบบ renin angiotensin system และเพิ่มระดับ cortisol ได้ดังตารางที่ 1.8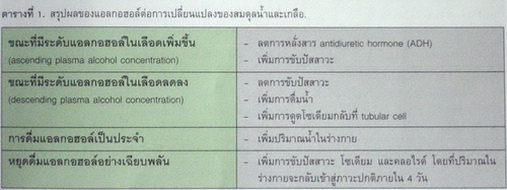
ภาวะ beer potomania เป็นปรากฏการณ์ที่พบในผู้ที่ดื่มเบียร์เป็นปริมาณมาก เฉลี่ย 5 ลิตรต่อวัน โดยสม่ำเสมอ ส่งผลให้เกิดภาวะขาดสารอาหาร และลดความสามารถในการขับน้ำออกจากร่างกาย (impaired free water excretion) เนื่องจากปกติ เบียร์มีปริมาณโซเดียมน้อยกว่า 2 มิลลิโมลต่อลิตร ระดับซีรั่มโซเดียมอาจจะลดลงไปถึงระดับ 100 มิลลิโมลต่อลิตรได้.14
Hypophosphatemia
พบอุบัติการณ์สูงถึงร้อยละ 30-50 ของผู้ที่ติดสุราเรื้อรังที่เข้ารักษาตัวในโรงพยาบาล.15 แอลกอฮอล์มีผลลดระดับฟอสเฟตในเลือดโดยการขับออกทางปัสสาวะ เนื่องจากขาดวิตามิน D และมีภาวะ secondary hyperparathyroidism พบว่าเมื่อหยุดดื่มแอลกอฮอล์เป็นเวลา 4 สัปดาห์ กลไกการดูดซึมฟอสเฟตกลับในไตจะกลับมาทำงานเป็นปกติ.16 นอกจากนั้นยังมีการลดการดูดซึมฟอสเฟตที่ลำไส้เนื่องจากมีอาการอาเจียน ท้องเสีย และกินอาหารได้น้อย ผลเสียที่เกิดขึ้นเมื่อระดับฟอสเฟตในเลือดต่ำได้สรุปไว้ในตารางที่ 2. 
Hypomagnesemia
กลไกที่ระดับแมกนีเซียมในเลือดลดลงคล้ายคลึงกับกลไกของฟอสเฟต คือ มีการสูญเสียแมกนีเซียมทางปัสสาวะเพิ่มขึ้น และเมื่อหยุดดื่มแอลกอฮอล์เป็นเวลา 4 สัปดาห์ กลไกการดูดซึมแมกนีเซียมกลับของไตจะกลับมาทำงานเป็นปกติ นอกจากนั้นภาวะภาวะที่มีโพแทสเซียมในเลือดต่ำ จากอาการอาเจียน ท้องเสีย และการขาดสารอาหาร ยังเป็นปัจจัยร่วมที่ทำให้สูญเสียแมกนีเซียมออกมาทางปัสสาวะ สุดท้ายพบว่าภาวะความดันเลือดที่สูงมีผลลดการดูดกลับแมกนีเซียมที่ไตด้วย.9
Hypocalcemia
มีทั้งการสูญเสียไปทางปัสสาวะและการลดการดูดซึมกลับที่ไต ร่วมกับการที่มีระดับแมกนีเซียมในเลือดต่ำทำให้เกิดภาวะ PTH resistance และภาวะการขาด PTH นอกจากนั้น แอลกอฮอล์ยังทำให้เกิดภาวะ steatorrhea และทำให้การทำงานของตับเสื่อมลง.17
2.2 ผลกระทบของแอลกอฮอล์ที่มีต่อสมดุลกรดด่างของร่างกาย
ภาวะ alcoholic ketoacidosis18
เกิดในผู้ที่ดื่มสุราเรื้อรัง มักเกิดภาวะนี้ภายหลังการดื่มสุราปริมาณมาก ซึ่งจะตามมาด้วยอาการคลื่นไส้ อาเจียน และการอดอาหาร นำไปสู่ภาวะ ketoacidosis. ภาวะ alcoholic ketoacidosis อาจเป็น ลักษณะรุนแรงที่สุดของภาวะ starvation ketosis การบริโภคคาร์โบไฮเดรตลดลงร่วมกับการยับยั้งกระบวนการ gluconeogenesis โดยแอลกอฮอล์ ทำให้มี lipolysis เพิ่มขึ้น. การอดอาหารร่วมกับการหยุดดื่ม สุราและภาวะ volume depletion ทำให้ cathe colamine สูงขึ้น : ซึ่งจะยิ่งไปกระตุ้นกระบวนการ lipolysis และเพิ่มระดับ free fatty acid.
ภาวะ alcoholic ketoacidosis มักเกิดร่วมกับภาวะ lactic acidosis และระดับน้ำตาลในเลือดต่ำ. ภาวะ lactic acidosis เกิดจากภาวะการสูญเสียน้ำ เนื่องจากการอาเจียนและกินลดลง. นอกจากนี้ ethanol oxidation จะเพิ่มอัตราส่วน NAD/NAD+ ทำให้ lactic acidosis มากขึ้น และทำให้ acetoacetate กลายเป็น ß-hydroxyl butyrate บางส่วนของแอลกอฮอล์ยังถูกย่อยสลายเป็น acetic acid.
อาจตรวจพบความผิดปกติของสมดุลกรดด่างอื่นๆ คือ ภาวะ metabolic alkalosis (เป็นผลจากการอาเจียน ทำให้ผู้ป่วยมีค่า arterial pH ค่อนข้างปกติ อาจพบแต่การเพิ่มขึ้นของ anion gap อย่างเดียว ภาวะ respiratory alkalosis (เนื่องจากผู้ป่วยมักมีโรคตับเรื้อรัง) ภาวะ normal anion gap metabolic acidosis (มีการสูญเสีย ketoacid anions ทางปัสสาวะ).
การวินิจฉัยภาวะ alcoholic ketoacidosis ควรสงสัยภาวะนี้ในผู้ป่วยที่มีประวัติดื่มสุราจัด ที่มีภาวะ high anion gap metabolic acidosis ซึ่งมีระดับน้ำตาลในเลือดอยู่ในเกณฑ์ปกติหรือสูงขึ้นเพียงเล็กน้อย และมีค่า serum osmolarity เพิ่มขึ้น การวินิจฉัยที่แน่นอนคือการตรวจเลือดพบ ketone โดยอาศัย nitroprusside (acetate test) tablets ทำปฏิกิริยากับซีรั่มเจือจาง 1 : 1 หากได้ผล 4+ บ่งชี้ภาวะ ketoacidosis พบว่า nitroprusside ทำปฏิกิริยากับ acetone และ acetoacetic acid แต่ ไม่ทำปฏิกิริยากับ ß-hydroxybutyric acid ใน alcoholic ketoacidosis พบว่า ß-hydroxybutyric acid อาจมีค่าสูงถึงร้อยละ 90 ของ ketone ในเลือด ทำให้เมื่อทำการตรวจ ketone จะได้ผลเป็นลบ ดังนั้นเพื่อช่วยในการตรวจหา ketone อาจใช้วิธีหยด H2O2 ในตัวอย่างปัสสาวะ H2O2 จะเปลี่ยน ß-hydroxybutyrate เป็น acetoacetate ทำให้ได้ผลการตรวจเป็นบวก.
การรักษา ภาวะ alcoholic ketoacidosis มักหายเป็นปกติ เมื่อได้รับ glucose และน้ำเกลือทางหลอดเลือด. การให้ glucose ช่วยแก้ไขภาวะ hypoglycemia เพิ่มอัตราส่วนของ insulin/glucagon จึงลดการสร้าง ketoacid การให้สารน้ำทางหลอดเลือดจะทำให้ลดระดับ catecholamine ลดการ เกิด lactic acidosis มักไม่มีความจำเป็นต้องให้อินซูลินถ้าผู้ป่วยไม่ได้เป็นโรคเบาหวาน มักไม่ต้องให้ NaHCO3 แก้ความเป็นกรดด่างเนื่องจากเมื่อระดับอินซูลินสูงขึ้น จะเปลี่ยน ketoacid เป็น HCO3 อย่างรวดเร็ว การให้ NaHCO3 อาจมีประโยชน์ใน 2 กรณี คือ
1) ภาวะเลือดเป็นกรดอย่างรุนแรง (arterial pH < 7.00-7.12),
2) มีลักษณะ normal anion gap metabolic acidosis เนื่องจากมีการขับ ketoacid anions ในปัสสาวะทำให้การแก้ปัญหา acidosis ล่าช้ากว่าที่ควรจะเป็น.
เอกสารอ้างอิง
1. Lieber CS. Medical disorders of alcoholism. N Engl J Med 1995;333:1058-65.
2. McElduff P, Dobson AJ. How much alcohol and how often? Population based case-control study of alcohol consumption and risk of a major coronary event. BMJ 1997 19;314:1159-64.
3. Perneger TV, Whelton PK, Puddey IB, Klag MJ. Risk of end-stage renal disease associated with alcohol consumption. Am J Epidemiol 1999;150:1275-81.
4. Parenti P, Giordana B, Hanozet GM. In vitro effect of ethanol on sodium and glucose transport in rabbit renal brush border membrane vesicles. Biochem Biophys Acta 1991;1070:92-8.
5. Rothman A, Proverbio T, Fernandez E, Proverbio F. Effect of ethanol on the Na(+) and the Na+, K(+)-ATPase activities of basolateral plasma membranes of kidney proximal tubular cells. Biochem Pharmacol 1992;43: 2034-6.
6. Parekh RS, Klag MJ. Alcohol: role in the development of hypertension and end stage renal disease. Curr Opin Nephrol Hypertens 2001;10:385-90.
7. Kalbfleisch JM, Lindeman RD, Ginn HE, Smith WO. Effects of ethanol administration on urinary excretion of magnesium and other electrolytes in alcoholic and normal subjects. J Clin Invest 1963;42:1471-5.
8. Vamvakas S, Tescher M, Bahner U, Heidland A. Alcohol abuse: potential role in electrolyte disturbances and kidney diseases. Clin Nephrol 1998;49:205-13.
9. Thiel DH, Gavaler JS, Little JM, Lester R. Alcohol: its effect on the kidney. Metabolism 1977;26:857- 66.
10. Peters H, Martini S, Woydt R, Ruckert M, Shimizu F, Kawachi H, et al. Moderate alcohol intake has no impact on acute and chronic progressive anti-thy1 glomerulonephritis. Am J Physiol Renal Physiol 2003; 284:F1105-14.
11. Tesar V, Zima T, Poledne R, Stejskalova A, Stipek S, Teminova J. The influence of chronic ethanol admi-nistration on adriamycin-induced nephrotic syndrome in rats. Alcohol Alcohol 1995;30:47-53.
12. Knight EL, Stampfer MJ, Rimm EB, Hankinson SE, Curhan GC. Moderate alcohol intake and renal function decline in women : a prospective study. Nephrol Dial Transplant 2003;18:1549-54.
13. Schaeffner ES, Kurth T, de Jong PE, Glynn RJ, Buring JE, Gaziano JM. Alcohol consumption and the risk of renal dysfunction in apparently healthy men. Arch Intern Med 2005;165:1048-53.
14. Hilden T, Svendsen TL. Electrolyte disturbances in beer drinkers. A specific hypoosmolality syndrome. Lancet 1975;2:245-6.
15. Ryback RS, Eckardt MJ, Pautler CP. Clinical relationships between serum phosphorus and other blood chemistry values in alcoholics. Arch Interm Med 1980;329:1927-34.
16. De Marchi S, Cecchin E, Basile A, Bertotti A, Nardini R, Bartoli E. Renal tubular dysfunction in chronic alcohol abuse-effects ofabstinence. N Engl J Med 1993;329:1927-34.
17. Gascon-Barre M. Interrelationships between vitamin D3 and 25-hydroxyvitamin D3 during chronic ethanol administration in the rat. Metabolism 1982;31:67-72.
18. Wrenn KD, Slovis CM, Minion GE, Rutkowski R. The syndrome of alcoholic ketoacidosis. Am J Med 1991;91:119.
ณัฐชัย ศรีสวัสดิ์ พ.บ.
แพทย์ประจำบ้านต่อยอด สาขาวิชาโรคไต ภาควิชาอายุรศาสตร์
คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
ยิ่งยศ อวิหิงสานนท์ พ.บ.
ผู้ช่วยศาตราจารย์ สาขาวิชาโรคไต ภาควิชาอายุรศาสตร์
คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
- อ่าน 41,506 ครั้ง
 พิมพ์หน้านี้
พิมพ์หน้านี้




