หลังจากที่แนะนำให้รู้จักความปวดและการประเมินความปวดในบทความตอนที่ 1 แล้วนั้น เมื่อผู้รักษาสามารถวินิจฉัยความปวดได้แต่เนิ่นๆ และประเมินปวดได้แล้ว จึงควรมาทำความรู้จักกับการรักษาความปวด. ในที่นี้จะเน้นเฉพาะปวดเรื้อรังจากมะเร็งหรือโรคระยะสุดท้ายต่างๆ จะไม่เน้นเรื่องการรักษาปวดเฉียบพลันหรือปวดเรื้อรังอื่นๆ อาทิเช่น ปวดไมเกรน ปวดอุ้งเชิงกรานเรื้อรังจากเยื่อบุมดลูกเจริญผิดที่ ซึ่งมีการให้ยาที่แตกต่างกัน ในกลุ่มหลังต้องระมัดระวังเรื่องโอกาสในการติดยาได้เนื่องจากพยาธิสภาพในการปวดแตกต่างจากผู้ป่วยที่มีก้อนมะเร็งหรือโรคระยะสุดท้ายอื่นๆ และต้องการการรักษาที่ซับซ้อนกว่าการใช้ยาระงับปวดเพียงลำพัง.
หลักสำคัญในการรักษาปวด1-4
1. เชื่อว่าผู้ป่วยปวดจริง และความปวดเป็น ความเจ็บป่วยที่ต้องรักษา.
2. ประเมินปัจจัยองค์ประกอบของความปวดในขณะนั้น (total pain concept).
3. ใช้หลายวิธีร่วมกันในการรักษาปวดแต่ละครั้ง ตามแต่ละปัจจัยองค์ประกอบในข้อ 2.
4. เริ่มรักษาเร็วแต่เนิ่นๆ อย่าปล่อยให้ผู้ป่วยทนต่อความปวดไปก่อนจนทนไม่ไหว เพราะการอดทนต่อความปวด โดยเฉพาะปวดมะเร็งจะทำให้ความปวดเพิ่มทวีขึ้นในครั้งถัดไป จนควบคุมได้ยาก.
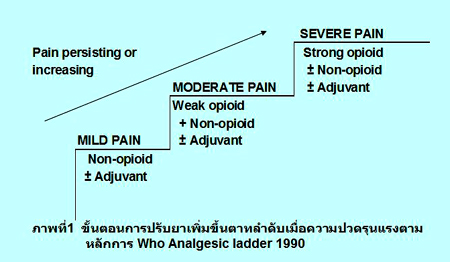
5. ใช้ยาระงับปวดและยาร่วม (co-analgesics) ตามหลักเกณฑ์ของ WHO Analgesic ladder 1990.
6. สำหรับผู้ป่วยที่ปวดประจำ (constant pain) ต้องให้ยาระงับปวดสม่ำเสมอตลอดวันแบบ regular dose และต้องสั่ง breakthrough dose หรือ prn dose ไว้ให้เรียกใช้เพิ่มได้ระหว่างวันด้วย.
7. ปรับขนาดยารายวันตามที่ผู้ป่วยใช้จริงจนสามารถคุมอาการปวดได้อย่างดี.
8. ถ้ากินได้ ให้เริ่มยากินก่อน เพื่อผู้ป่วยสามารถปรับยากินเองได้เมื่อกลับบ้าน.
9. หมั่นอธิบายและตรวจสอบความเข้าใจในการใช้ยาของผู้ป่วยและญาติเป็นระยะๆ รวมถึงผลข้างเคียงจากการใช้ยาระงับปวดด้วย.
การใช้ยาระงับความปวด (Pharmacological therapy)
การใช้ยาเพื่อระงับปวดจากมะเร็ง องค์การอนามัยโลกได้แนะนำให้เลือกใช้ยาแก้ปวดที่รุนแรงน้อยก่อน และปรับยาเพิ่มขึ้นตามลำดับเมื่อความ ปวดรุนแรงขึ้น โดยขั้นตอนการปรับยาใช้หลักการที่เรียกว่า WHO Analgesic ladder 1990 ประกอบด้วย 3 ขั้นตอน คือ
ขั้นตอนที่ 1. ยาระงับปวดกลุ่ม non- opioid เช่น ยาพาราเซตามอล หรือ NSAIDs หาก ผู้ป่วยมีอาการปวดไม่มาก ควรเริ่มเป็นยากลุ่มนี้ก่อน. ยาพาราเซตามอลให้ได้ไม่เกิน 4 กรัม/วัน. การให้ยา NSAIDs ให้ระวัง GI side effects แต่ไม่จำเป็นต้องสั่งยากลุ่ม H2-blocker หรือ cytoprotective drug ควบคู่ไปกับการสั่งยากลุ่ม NSAIDs เพราะไม่พบว่าช่วยป้องกัน drug-induced gastritis or bleeding หากอาการปวดไม่ดีหรือมีผลข้างเคียงจากการใช้ยากลุ่มนี้ให้เลือกใช้ยาในขั้นถัดไป.
ขั้นตอนที่ 2. ยาระงับปวดกลุ่ม weak-opioid เช่น ยา codeine, tramadol ยากลุ่มนี้มี ceiling effect แพทย์จึงต้องทราบเรื่องปริมาณยาสูงสุดที่ให้ได้ ผลข้างเคียงคล้ายกับกลุ่มที่ 3.
ขั้นตอนที่ 3. ยาระงับปวดกลุ่ม strong-opioid ได้แก่ มอร์ฟีนใช้ในผู้ป่วยมะเร็งที่มีอาการปวดมาก โดยการให้ยาเริ่มจากมอร์ฟีนชนิด rapid- release oral 5-10 มก. ทุก 4 ชั่วโมง. สามารถเพิ่มขนาดยาจนสามารถระงับปวดได้ และต้องให้ breakthrough dose ควบคู่ไปด้วยทุกครั้ง. ขนาดยาสำหรับ breakthrough dose คือร้อยละ 25-50 ของยาที่ได้ในแต่ละครั้งของ regular dose แต่สั่ง prn ทุก 1-2 ชั่วโมง เมื่อควบคุมความปวดได้ดีตลอด 24 ชั่วโมงจึงเปลี่ยนยามอร์ฟีนทุก 4 ชั่วโมงเป็นชนิด sustained-release คือทุก 8-12 ชั่วโมง และให้ชนิด rapid-release เป็น breakthrough dose ไว้ prn ทุก 1 ชั่วโมง. สำหรับยามอร์ฟีนไม่มีกำหนด maximum dose สามารถเพิ่มขนาดยาได้เรื่อยๆ จนกว่าจะระงับปวดได้.
ในกรณีผู้ป่วยต้องได้รับยามอร์ฟีนในขนาดที่สูง หรือไม่สามารถกินยาได้ อาจเปลี่ยนยาเป็นชนิดแปะผิวหนัง (fentanyl patch) หรือหยดเข้าหลอดเลือด.
ผลข้างเคียงของยา opioids ที่สำคัญที่สุดคือ ท้องผูก ฉะนั้นควรสั่งยาระบายเพื่อป้องกันอาการ ท้องผูกไว้ทุกครั้งที่สั่งยากลุ่มนี้ ส่วนผลข้างเคียงอื่นๆ ที่เกิดได้ เช่น คลื่นไส้อาเจียน ง่วงนอน จะเกิดขึ้นในช่วงแรกๆ ของการให้ยา.
สำหรับยาเสริม (adjuvants) ใช้ในกรณีต้องการลดผลข้างเคียงของยา opioids และใช้ใน อาการปวดที่ไม่ได้เกิดจาก nociceptive pain เช่น
- Tricyclic antidepressant : Amitriptyline เป็นยาหลักในการรักษา neuropathic pain ที่เป็นลักษณะแสบร้อนตามผิวหรือรู้สึกยุกยิกตามผิวโดยเริ่มจาก 25 มก.วันละครั้งก่อนนอน ในผู้ป่วยสูงอายุควรเริ่มจาก 10 มก.และสามารถปรับเพิ่มขนาดยาได้.
- Anticonvulsant : Gabapentin ใช้ในการรักษา neuropathic pain ที่เป็นลักษณะเหมือนไฟฟ้าแล่นแปล๊บ จนบางครั้งแขนขากระตุกใช้ได้ตั้งแต่ขนาด 300-1,800 มก./วัน.
- Corticosteroid : Dexamethasone การใช้ในขนาด 8 มก./วัน ในช่วงเช้าสามารถลด perineural edema และ nerve compression ได้หากหลังให้ยาแล้วประมาณ 2-3 วันยังไม่สามารถช่วยลดอาการปวดก็สามารถหยุดยาได้ แต่ถ้าช่วยลดอาการปวดได้ ให้ลดปริมาณยาลงเหลือ 2 มก./สัปดาห์เป็น maintainance dose.
ตัวอย่างการเริ่มสั่งยามอร์ฟีนในผู้ป่วย มะเร็งที่ไม่เคยได้ยามอร์ฟีน (opioidnaive patient)
หากประเมินแล้วผู้ป่วยมีอาการปวดมะเร็งอย่างมาก และผู้ป่วยไม่ได้รับยากลุ่ม strong opioids ในช่วง 24-48 ชั่วโมงที่ผ่านมา ให้ถือเป็น opioid- naive patient ซึ่งต้องเริ่มสั่งยาขนาดต่ำก่อนดังนี้
1. Anti-emetic drug : Haloperidol 0.5-1 มก.หรือ metoclopramide 5 มก. oral ประมาณ 1/2 ชั่วโมงก่อนให้มอร์ฟีน dose แรก.
2. Regular dose : Morphine short-acting 10-20 มก. oral q 4 ชั่วโมง.
3. Breakthrough dose : Morphine short-acting 5 มก. oral q 1 ชั่วโมง.
4. Bowel stimulant : Senakot 2-4 tab oral hs.
หากผู้ป่วยไม่สามารถกินยาทางปากได้ ให้สั่ง intravenous route ที่ลดขนาดลงครึ่งหนึ่งของ oral route และเมื่อต้องการเปลี่ยนจากยาฉีดมาเป็นยากินให้เพิ่มขนาดกลับเป็น 2-3 เท่าของยาฉีด.
เมื่อครบ 24 ชั่วโมงของการให้ยามอร์ฟีน ให้นำขนาดยาที่ผู้ป่วยได้จริงทั้ง regular dose และ breakthrough dose มารวมกัน เช่น สั่งยา morphine syrup (MSS) 10 มก. oral q 4 ชั่วโมง และ 5 มก. oral prn q 1 ชั่วโมง ผู้ป่วยเรียกใช้ breakthrough dose ไปทั้งหมด 12 ครั้งใน 1 วัน รวมจำนวนมอร์ฟีนที่ผู้ป่วยใช้จริง เท่ากับ (10 มก. ด 6 ครั้ง) + (5 มก. ด 12 ครั้ง) = 120 มก./วัน แสดงว่าสั่งยาแก้ปวดให้น้อยเกินไปในวันแรก จึงต้องเอาขนาดยาที่ใช้จริง มาคำนวณเป็น regular dose จะได้ 120/6 = 20 มก. oral q 4 ชั่วโมง สำหรับวันถัดไป รวมทั้งต้องปรับขนาดยา breakthrough dose เป็น 1/4-1/2 ของ regular dose จะได้ 20/4 หรือ 20/2 = 5-10 มก. oral q 1 ชั่วโมง.
หลังจากนั้นเมื่อครบอีก 24 ชั่วโมงให้ประเมินผู้ป่วยและคำนวณใหม่อีกครั้งตามจำนวนที่ผู้ป่วยใช้จริง จนกระทั่งปรับยาได้คงที่คือระดับที่ผู้ป่วยเรียกใช้ breakthrough dose ไม่เกิน 2-3 doses ต่อวันจึงสามารถปรับยาจาก morphine short-acting เป็น sustained release (MST) ที่สั่งจ่ายทุก 8-12 ชั่วโมง ซึ่งง่ายต่อการบริหารยาที่บ้าน แต่ต้องสั่ง MSS เป็น breakthrough dose ควบคู่ไปด้วย ทั้งนี้พบว่าจะไม่มี upper limit ของขนาดยามอร์ฟีนที่ควรจะได้รับ หรือผลกดการหายใจ หากค่อยๆ ปรับยาตามหลักการดังกล่าวมา. ดังนั้นจึงเพิ่มขนาดยาได้เรื่อยๆ ตามอาการปวดมะเร็งของผู้ป่วยแต่ละคนที่ไม่เท่ากัน จนผู้ป่วยสามารถอยู่ได้สบาย โดยไม่ปวด สามารถทำกิจวัตรได้ตามสมควร.
หลังจากได้ระดับยาที่คงที่แล้ว และผู้ป่วยไม่สามารถกินยาได้ อาจเปลี่ยนเป็นรูปแปะผิวหนัง เช่น fentanyl patch 1 patch q 72 ชั่วโมง อย่างไรก็ตาม ระวังการใช้ fentanyl patch เร็วเกินไป เพราะหากยังปรับยาไม่ได้ระดับคงที่ fentanyl patch จะออกฤทธิ์นานถึง 3 วัน หากเกินขนาดก็ต้องรอร่างกายขับยาออกถึง 3 วัน. การปรับระดับยาขณะได้ fentanyl ทำได้ลำบาก หากเป็นไปได้ควรให้ยากินจะดีกว่า เพราะจะดูดซึมยาได้ดีไม่ว่าร่างกายผู้ป่วยจะเป็นอย่างไร เพียงแต่ต้องลดอาการคลื่นไส้อาเจียนจากยา ให้ได้ก่อน ผู้ป่วยจึงจะไม่กลัวที่จะใช้ยา.
เมื่อเลือกใช้ opioids แล้ว ให้เลือกใช้ชนิดใดชนิดหนึ่งทีละอย่าง อย่าใช้ผสมกัน เช่น weak opioids และ strong opioids ทำให้ปรับยายากและอาจเกิดผลข้างเคียงจาก ceiling effect ของยาที่ผสมอยู่.
ผลข้างเคียงของ strong opioids
1. Nausea-vomiting เกิดได้ร้อยละ 50-70 ของ opioid-naive patients จึงควรสั่งยา anti emetic drugs ควบคู่ไปด้วยทุกครั้ง โดยเฉพาะช่วง 2-3 วันแรก. อย่างไรก็ตาม ควรหาสาเหตุของคลื่นไส้อาเจียนในทุกครั้งว่าเป็นจากสาเหตุอื่นหรือไม่ และแก้ไขตามสาเหตุจริง อย่าเหมารวมหมดว่าเกิดจากมอร์ฟีนอย่างเดียว.
2. Constipation พบได้เกือบร้อยละ 100 ของทุกคนที่ได้รับยา opioids จึงต้องสั่งยาระบายให้ทุกครั้ง และมักจะเป็นตลอดไปตราบเท่าที่ยังใช้ยา opioids อยู่ อย่ารอให้ผู้ป่วยขอยาระบาย ต้องประเมินเรื่องการขับถ่ายอย่างระมัดระวังทุกวันที่สั่งยา opioids กลุ่มยาที่ควรให้คือ stool softener และ bowel stimulants.
3. Sedation พบได้บ่อยใน Opioid-naive patients โดยเฉพาะช่วง 2-3 วันแรก ไม่ต้องทำอะไรหรือไม่ต้องปรับขนาดยาลง อธิบายให้ญาติเข้าใจล่วงหน้าว่าอาจเกิดอาการนี้ในช่วง 2-3 วันแรกเท่านั้น.
4. Confusion อาจเกิดได้ในผู้ป่วยสูงอายุโดยเฉพาะช่วง 2-3 วันแรก หากอาการไม่รุนแรงก็อธิบายให้ญาติเข้าใจ หรืออาจให้ยากลุ่ม haloperidol ขนาดต่ำๆ หากอาการรุนแรง อาจต้องพิจารณาลดขนาดยาลงหรือเปลี่ยนกลุ่มยา. อย่างไรก็ตาม ควรหาสาเหตุอื่นร่วมด้วย และแก้ไขตามสาเหตุจริง.
5. Myoclonus เกิดในรายที่ได้รับยาเกินขนาด (opioids toxicity) จึงควรปรับลดขนาดยาลงอย่างระมัดระวัง และอาจให้ยาเสริมในกลุ่ม lorazepam, midazolam, clonazepam, diazepam เพื่อลดอาการดังกล่าว.
6. Urinary retention พบน้อยอาจพบได้ในผู้สูงอายุ โดยเฉพาะผู้ชายที่มี bladder outlet obstruction อยู่ก่อนแล้ว.
7. Dry mouth พบได้น้อย ให้ดื่มน้ำมากขึ้น.
8. อาการอื่นๆ ที่พบน้อย เช่น sweating, pruritus, postural hypotension, vertigo.
ความเชื่อผิดๆ เกี่ยวกับมอร์ฟีน
1. Respiratory depression ปรากฏว่าไม่พบการกดการหายใจหากใช้การ titrate dose ในขณะเพิ่มขนาดยา หากฉีดเข้าเส้น ต้องเจือจางก่อนและฉีดช้าๆ.
2. Addiction or drug dependence ตราบใดที่ผู้ป่วยมีอาการปวดจริงการใช้ยาระงับปวดถือว่ามีข้อบ่งชี้ในการรักษา ในขณะที่การติดยาใช้สำหรับผู้ ที่ไม่ได้ใช้ยาเพื่อการรักษาอาการปวด แต่ใช้ยาเพื่อวัตถุประสงค์อื่น เป็นการใช้ยาผิดประเภท และผู้ที่ ติดยามักจะมีปัญหาจิตสังคมอื่นๆ อยู่ก่อน แต่ใช้ยา เพื่อให้ลืมภาวะวิกฤติเหล่านั้น ซึ่งเป็นคนละวัตถุประสงค์กับการรักษาปวด. ดังนั้นหากผู้ใช้ยามอร์ฟีนรักษาปวดมีอาการติดยาก็จะเป็น pharmacological dependence ซึ่งสามารถเลิกได้ แตกต่างจาก psychological dependence.
การระงับปวดโดยไม่ใช้ยา (non-pharmacological therapy)
วิธีระงับปวดจากมะเร็งมีหลายวิธี เช่น รังสีรักษา เคมีบำบัด ผ่าตัด ทำ nerve block, electrical stimulation, rehabilitation, psychological intervention ซึ่งมีรายละเอียดแตกต่างกันไปตามชนิดของมะเร็ง.
บทสรุป
จะเห็นได้ว่า ปัจจุบันมีแนวคิดในการรักษาอาการปวดมะเร็งที่กว้างขวางและหลากหลายขึ้น ยังมีบทเรียนอีกมากเกี่ยวกับ pain management in palliative care. บทความข้างต้นเป็นพื้นฐานหลักที่แพทย์ทั่วไปควรรู้ เพื่อที่จะสามารถนำไปใช้กับผู้ป่วยได้โดยไม่กลัวการใช้ยากลุ่ม strong opioids. ผลข้างเคียงเรื่องกดการหายใจเป็นเพียงความเชื่อ แต่ไม่เกิดจริงในการรักษาปวดมะเร็ง และผลร้ายเรื่องติดยาก็เป็นเพียงเรื่องความกลัวและความ เข้าใจผิดของบุคลากรเกี่ยวกับการติดยา. แพทย์ทั่วไปจะสามารถปรับยาเป็นก็ต้องลองใช้ยาดูก่อน แล้วจะรู้ว่าการปรับยาไม่ยากอย่างที่คิด เมื่อเริ่มลองใช้หลังจากเอาชนะความกลัวของผู้รักษาเองได้ เมื่อนั้นผู้ป่วยและญาติก็จะได้รับอานิสงค์นั้นไปด้วย.
เอกสารอ้างอิง
1. World Health Organization. Cancer Pain Relief. Geneva : World Health Organization Office of Publications, 1990.
2. Cancer Pain : A Monograph on the Management of Cancer Pain. A report of the expert advisory committee on the management of severe chronic pain in cancer patients. Health and Welfare Canada, Minister of Supply and Services, 1984:20.
3. Principles of analgesic use in the treatment of acute pain and cancer pain. 3rd ed. American Pain Society, 1992.
4. Management of cancer pain. Clinical practice guidelines. U.S. Department of Health and Human Services, Agency for Health Care Policy and Research, 1994.
5. Librach SL, Squires BP. The Pain Manual : Principles and issues in cancer pain assessment. Toronto : Pegasus Healthcare International, 1997.
มนฑรัตม์ จินดา พ.บ.(แพทย์ประจำบ้านชั้นปีที่ 3)
สายพิณ หัตถีรัตน์ พ.บ., ว.ว. (เวชปฏิบัติทั่วไป), อ.ว.(เวชศาสตร์ครอบครัว),ผู้ช่วยศาสตราจารย์ ภาควิชาเวชศาสตร์ครอบครัว ,คณะแพทยศาสตร์โรงพยาบาลรามาธิบดี มหาวิทยาลัยมหิดล
- อ่าน 27,626 ครั้ง
 พิมพ์หน้านี้
พิมพ์หน้านี้




