ความต้องการวิธีวินิจฉัยโรคแต่เนิ่นๆ มีอยู่ตลอดเวลา PET-CT สแกนเป็นทางเลือกใหม่ในประเทศ ไทย มีลักษณะแตกต่างจากการตรวจถ่ายภาพอื่นๆ อาทิ CT สแกนและ MRI ดังจะได้ขยายความดังต่อไปนี้
PET (Positron Emission Computed Tomography) สแกน คืออะไร
PET สแกนเป็นการตรวจถ่ายภาพโดยใช้สารเภสัชที่ติดสลากกับไอโซโทปที่ให้อนุภาคโพสิตรอนปริมาณเล็กน้อยเข้าไปในร่างกาย เพื่อไปจับกับความผิดปกติที่ต้องการตรวจแล้วเปล่งแสงออกมาให้เห็นโดยการถ่ายภาพด้วยเครื่อง PET สแกน. การตรวจนี้จึงเป็นการตรวจถ่ายภาพระดับโมเลกุลซึ่งจะพบ ความผิดปกติได้ก่อนความผิดปกติทางกายวิภาคและมีความจำเพาะมากกว่า. อย่างไรก็ตามเนื่องจากภาพที่ได้จาก PET สแกนแสดงเฉพาะความผิดปกติ จึงเป็นการยากที่จะบ่งตำแหน่งที่ผิดปกติได้อย่างชัดเจน ในปัจจุบันจึงมีการนำเทคโนโลยีของเอกซเรย์คอมพิวเตอร์มารวมในเครื่องเดียวกันเป็น PET-CT สแกน.
PET-CT นำมาใช้ตรวจโรคอะไรได้บ้าง
สำหรับการตรวจ PET-CT ในปัจจุบัน โรงพยาบาลส่วนใหญ่จะใช้สารเภสัชรังสีคือ 18F-FDG (fluorodeoxy glucose) ซึ่งในทางคลินิกนั้นมีข้อบ่งชี้ในการตรวจดังนี้
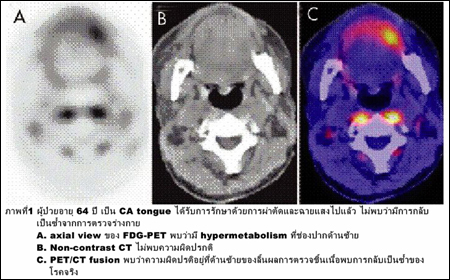
1. โรคมะเร็ง จะช่วยในแง่การวินิจฉัยแยกระหว่างเนื้องอกชนิด benign และ malignant (ภาพที่ 1)
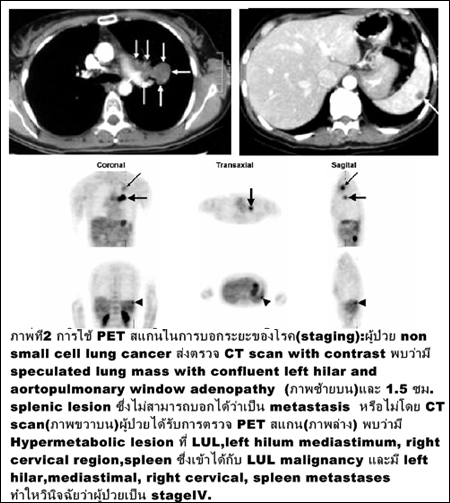
การตรวจหาระยะของโรคมะเร็ง (ภาพที่ 2)
การติดตามผลการรักษาเพื่อเลือกยาโดยเฉพาะยาเคมีบำบัดว่ามะเร็งมีการตอบสนองหรือไม่ (ภาพที่ 3)
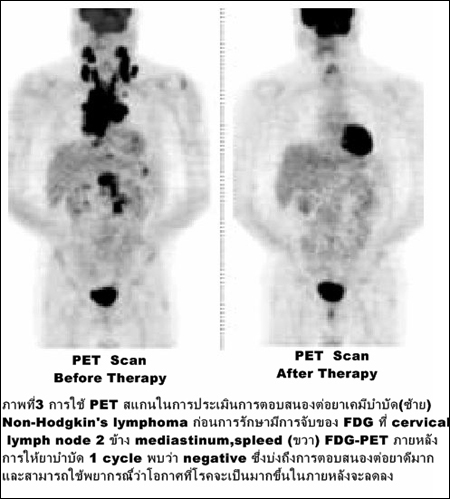
และสมควรเปลี่ยนยาหรือไม่โดยจะเห็นการตอบสนองก่อนการเปลี่ยนแปลงขนาดโดยอัลตราซาวนด์, เอกซเรย์คอมพิวเตอร์หรือการตรวจคลื่นสะท้อนสนามแม่เหล็ก (MRI) นอกจากนี้ยังใช้ในการติดตามเพื่อตรวจการกลับเป็นซ้ำของโรคมะเร็ง และการพยากรณ์โรค.
2. ความผิดปกติของสมอง อาทิ Alzhei-mer 's disease, Parkinson ' s disease, Epilepsy โดยจะช่วยตรวจหาโรคหรือพยากรณ์การเกิดโรคก่อนจะตรวจพบในทางคลินิก โดยเฉพาะใน mild cognitive impairment ที่อาจเปลี่ยนไปเป็น Alzheimer (ภาพที่ 4)
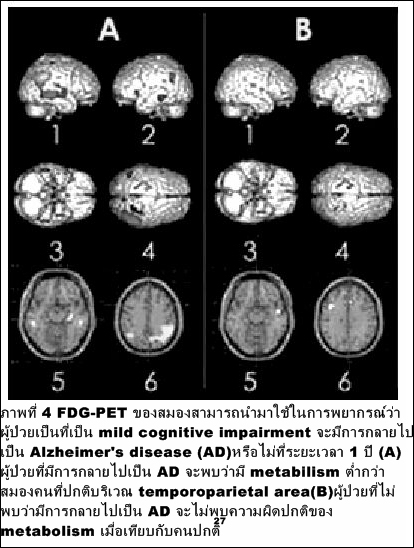
ช่วยในการวินิจฉัยแยกระหว่างสมองเสื่อมชนิดต่างๆ (ภาพที่ 5)

รวมทั้งการแยกจาก pseudodementia ที่เกิดจาก depression เพื่อให้การรักษาที่ถูกวิธี ช่วยในการวินัจฉัยแยกระหว่างโรคที่ให้ความผิดปกติของการเคลื่อนไหว (movement disorder) ต่างๆ และช่วยในการตรวจหาบริเวณที่ทำให้เกิดการ ชักในกรณีที่ผลการตรวจอื่นๆ ไม่สอดคล้องกันหรือในรายที่ MRI ให้ผลลบ รวมทั้งช่วยพยากรณ์การหายจากการชักหลังการผ่าตัดได้ เป็นต้น.
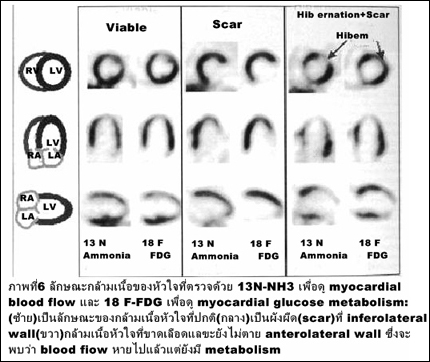
3. โรคหัวใจ จะช่วยในการวินิจฉัยว่ากล้ามเนื้อหัวใจที่มีการขาดเลือดและลดการหดตัวนั้นยังมีชีวิตอยู่หรือไม่ (myocardial viability) โดยจะวินิจฉัยร่วมกับการตรวจดูเลือดไปเลี้ยงกล้ามเนื้อหัวใจ (myocardial perfusion study) โดยวิธีทาง SPECT หรือ PET (ภาพที่ 6) ซึ่งหากกล้ามเนื้อหัวใจยังมีชีวิตอยู่ ก็จะให้การรักษาโดยวิธี revascularization แทนที่จะต้องไปทำการปลูกถ่ายหัวใจ (heart transplantation).
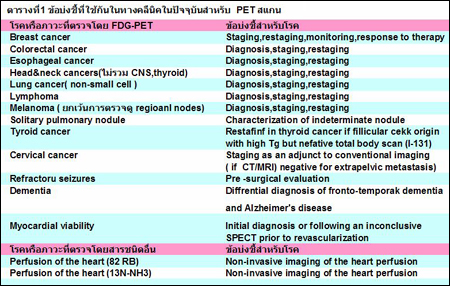
ในปัจจุบันสำหรับประเทศสหรัฐอเมริกานั้น การตรวจนี้สามารถเบิกค่ารักษาพยาบาลได้ในบางข้อบ่งชี้ ที่มีการศึกษาสนับสนุน1 ซึ่งในประเทศไทยโดยสมาคมเวชศาสตร์นิวเคลียร์ แห่งประเทศไทย ก็ได้เสนอให้มีการเบิกค่าตรวจตามข้อบ่งชี้คล้ายคลึงกับของต่างประเทศ ดังตารางที่ 1 (ในขณะนี้ยังอยู่ในการดำเนินการตกลงกับกรมบัญชีกลาง).
สารเภสัชรังสีที่ใช้ตรวจ
ถึงแม้สารที่ให้เป็นรังสีและให้เข้าไปในตัวผู้ป่วย แต่อย่างไรก็ตามปริมาณรังสีที่ได้รับจากไอโซโทปที่ใช้กันในปัจจุบัน 4 ชนิดคือ 11C,13N,15O,18F มีปริมาณเทียบเท่าหรือน้อยกว่าการตรวจเอกซเรย์คอมพิวเตอร์2 เนื่องจากสารเหล่านี้มีค่าครึ่งชีวิตสั้นมาก. นอกจากนี้ การตรวจ PET สแกนจะไม่มีการแพ้เนื่องจากสารเภสัชรังสีที่ให้ส่วนใหญ่เป็นสารที่เป็นหรือคล้ายคลึงกับส่วนประกอบในร่างกายหรือเป็นสารที่ร่างกายต้องใช้อยู่แล้ว การตรวจ PET สแกนจึงมี ความปลอดภัยสูง. อย่างไรก็ดี การตรวจ PET สแกนในปัจจุบันมักตรวจพร้อมกับเอกซเรย์คอมพิวเตอร์ตามที่กล่าวมาแล้ว หากมีการฉีดสารทึบรังสีอาจมีการแพ้ได้.
สารเภสัชรังสีที่ใช้กันมากที่สุดในปัจจุบันคือ8F-FDG ซึ่งเป็น glucose analogue. การจับของสารนี้กับเนื้อเยื่อจะบ่งถึง metabolic activity ซึ่งจะมีมากในเซลล์มะเร็งและการอักเสบต่างๆ การตรวจนี้จึงมีความไวมากและมีความจำเพาะดีพอสมควร อย่างไรก็ดีในปัจจุบันมีการพัฒนาสารเภสัชรังสีชนิดใหม่ๆ ที่มีความจำเพาะมากขึ้น.3
ทำไมต้องใช้ PET สแกน
สาเหตุที่ต้องใช้ PET สแกนในการร่วมวินิจฉัยโรคในปัจจุบันเนื่องจากความสามารถของการตรวจวิธีนี้และความคุ้มค่านั่นเอง ดังรายละเอียดข้างล่างนี้
¾ ความสามารถในการวินิจฉัยโรคของ FDG-PET เมื่อเทียบกับการตรวจโดยวิธีอื่น
ตารางที่ 2 เป็นตัวอย่างการศึกษาเปรียบเทียบ PET สแกนกับ CT สแกน.

จากตารางที่ 2 จะเห็นได้ว่า PET สแกนมีความไวและความจำเพาะต่อโรคมะเร็งมากกว่า CT สแกน ทั้งในการวินิจฉัย การหาระยะของโรค และการตรวจการกลับเป็นซ้ำของโรค. และในปัจจุบันที่ใช้ PET-CT สแกนยิ่งเพิ่มความแม่นยำในการวินิจฉัย.
¾ ผลต่อการเปลี่ยนแปลง management ในโรคต่างๆ เมื่อใช้ PET สแกน พบว่าการใช้ PET สแกนเปลี่ยนแปลงวิธีการรักษาได้ตั้งแต่ร้อยละ 30-50 ในกรณีมะเร็งของหลอดอาหารและกระเพาะ 7มะเร็งของลำไส้ใหญ่8 และมะเร็งปอด9 ไปจนถึงร้อยละ 30-9310 ในกรณีมะเร็งเต้านม11 เนื่องจากช่วยให้การวินิจฉัยระยะของโรคชัดเจนมากขึ้น.
¾ ความคุ้มค่าของ PET-CT สแกน
ในโรคบางชนิดการใช้ PET-CT ร่วมในการวินิจฉัย เช่น การรักษา non-small cell lung cancer พบว่าสามารถลดค่าใช้จ่ายในการรักษาลง 1,455 เหรียญแคนาดา เมื่อเทียบกับการใช้ CT สแกน อย่างเดียวและยังช่วยยืดอายุผู้ป่วยเพิ่มขึ้น 3.1 วัน12 ในมะเร็งตับอ่อน13 และการประเมิน metachronous liver metastasis ในมะเร็งของลำไส้ใหญ่14 ก็พบว่าลดค่าใช้จ่ายและช่วยเลือกผู้ป่วยสำหรับการรักษาที่เหมาะสม.
ข้อจำกัดของ PET สแกน
ถึงแม้ว่า PET สแกนจะมีประโยชน์ในหลายโรค ยังมีข้อจำกัดในหลายแง่ ดังต่อไปนี้
1. การเกิดผลลบลวง เช่น การวินิจฉัยและจัดระยะโรคของมะเร็งต่อมลูกหมาก15, การบ่งชี้การกลายเป็นมะเร็งของ cirrhotic nodule ในตับ16, มะเร็งที่มีขนาดน้อยกว่า 1 ซม.17, มะเร็งเต้านมชนิด lobular carcinoma5 , มะเร็งปอดชนิด bronchoalveolar cell18 และ bronchial carcinoid19 เป็นต้น.
2. การเกิดผลบวกลวง เช่น การอักเสบจากการติดเชื้อและไม่ติดเชื้อต่างๆ เช่น tuberculosis20, histoplasmosis21, aspergillosis22, sarcoidosis23, การอักเสบหลังฉายรังสี หลังการผ่าตัด หรือหลังการให้ยาเคมีบำบัด24 เป็นต้น.
ควรจะส่งตรวจเมื่อใดภายหลังการรักษา
ถึงแม้ว่าการตรวจด้วย PET สแกนเป็นวิธีการที่ดีในการติดตามการรักษา แต่หากส่งตรวจในระยะเวลาที่ไม่เหมาะสมอาจทำให้ผลที่ได้ผิดพลาด ต่อไปนี้เป็นข้อแนะนำเกี่ยวกับระยะเวลาที่ควรเว้นก่อนส่งตรวจ17
1. ภายหลังการตัดชิ้นเนื้อเพื่อการวินิจฉัย (biopsy) : 1 สัปดาห์.
2. หลังการผ่าตัด : 6 สัปดาห์ (ขึ้นกับชนิดการผ่าตัด).
3. หลังการให้ยาเคมีบำบัด : 4-6 สัปดาห์.
4. หลังการฉายรังสี : 4-6 เดือน.
5. หลังการให้ยากระตุ้นการทำงานของไขกระดูก : 5 วัน.
สรุป
การตรวจ PET สแกนมีความไวและความจำเพาะสูงในโรคต่างๆ ที่กล่าวมา และสามารถลดการตรวจและการรักษาที่ไม่จำเป็นอื่นๆ ลงไปได้ ทำให้การวินิจฉัยและการวางแนวทางการรักษาโรคเหมาะสมกับผู้ป่วยรายนั้นๆมากขึ้น. อย่างไรก็ดี การส่งตรวจสำหรับข้อบ่งชี้อื่นๆ ที่ไม่ได้กล่าวมายังมีการศึกษาสนับสนุนจำกัดจึงต้องรอผลวิจัยความสามารถและความคุ้มค่าต่อการส่งตรวจก่อนนำมาใช้.
เอกสารอ้างอิง
1. www.petscaninfo.com/zportal/portals/pat/my_pet_scan/pet_medicare<
2. Von Schulthess GK. Radiopharmaceuticals for clinical PET, PET/CT, and SPECT/CT imaging. In : Von Schulthess GK, ed. Clinical molecular anatomic imaging. PET, PET/CT, and SPECT/CT. Philadelphia : Lippincott Williams &Wilkins, 2003:103-5.
3. Ametamey SM. PET radiopharmaceuticals. Alasbimn Journal 2002;5:AJ18-11.
5. Avril N, Rose CA, Schelling M, et al. Breast imaging with positron emission tomography and (fluorine-18)–fluorodeoxyglucose : use and limitation. J Clin Oncol 2000;18:3495-502.
6. Gambhir SS, Czernin J, Schwimmer J, et al. A tabulated summary of the FDG PET literature. J Nucl Med 2001;42 (suppl 5):1S-93S.
7. Duong CP, Demitriou H, Weih L, et al. Significant clinical impact and prognostic stratification provided by FDG-PET in the staging of oesophageal cancer. Eur J Nucl Med Mol Imaging 2006;33:759-69.
8. Meta J, Seltzer M, Schiepers C, et al. Impact of 18F-FDG PET on managing patients with colorectal cancer: the referring physicianีs perspective. J Nucl Med 2001;42:586-90.
9. Gabriele P, Malinverni G, Moroni GL, et al. The impact of 18F-deoxyglucose positron emission tomography on tumor staging, treatment strategy and treatment planning for radiotherapy in a department of radiation oncology. Tumori 2004;90:579-85.
10. Grahek D, Montravers F, Kerrou K, et al. [18F]FDG in recurrent breast cancer : diagnostic performances, clinical impact and relevance of induced changes in management. Eur J Nucl Med Mol Imaging 2004;31: 179-88.
11. Yap CS, Seltzer MA, Schiepers C, et al. Impact of whole-body 18F-FDG PET on staging and managing patients with breast cancer: the referring physicianีs perspective. J Nucl Med 2001;42:1334-7.
12. Sloka JS, Hollett PD, Mathews M. Cost-effectiveness of positron emission tomography for non-small cell lung carcinoma in Canada. Med Sci Monit 2004;10:MT7380.
13. Heinrich S, Goerres GW, Schafer M, et al. Positron emission tomography/computed tomography influences on the management of resectable pancreatic cancer and its cost-effectiveness. Ann Surg 2005;242:235-43.
14. Lejeune C, Bismuth MJ, Conroy T, et al. Use of a decision analysis model to assess the cost-effectiveness of 18F-FDG PET in the management of metachronous liver metastases of colorectal cancer. J Nucl Med 2005; 46:2020-28.
15. Effert PJ, Bares R, Handt S, et al. Metabolic imaging of untreated prostate cancer by positron emission tomography with 18fluorine-labeled deoxyglucose. J Urol 1996;155:994-8.
16. Khan MA, Combs CS, Brunt EM, et al. Positron emission tomography scanning in the evaluation of hepatocellular carcinoma. J Hepatol 2000;32:792-7.
17. Lin EC, Alavi A. Interpretation of FDG PET studies. In : Lin EC, Alavi A, eds. PET and PET/CT : A clinical guide. New York : Thieme, 2005:55-63.
18. Yap CS, Schiepers C, Fishbein MC, et al. FDG-PET imaging in lung cancer : how sensitive is it for bronchoalveolar carcinoma? Eur J Nucl Med Mol Imag 2002;29:1166-73.
19. Erasmus JJ, McAdams HP, Patz EF Jr, et al. Evaluation of primary pulmonary carcinoid tumors using FDG PET. Am J Roentgenol 1998;170:1369-73.
20. Goo JM, Im JG, Do KH, et al. Pulmonary tuberculoma evaluated by means of FDG PET : Findings in 10 cases. Radiology 2000;216:117-21.
21. Croft DR, Trapp J, Kernstine K, et al. FDG-PET imaging at the diagnosis of non-small cell lung cancer in a region of high histoplasmosis prevalence. Lung cancer 2002; 36:297-301.
22. Wilkinson MD, Fulham MJ, McCaughan BC, et al. Invasive aspergillosis mimicking stage IIIA non-small-cell lung cancer on FDG positron emission tomography. Clin Nucl Med 2003;28:234-5.
23. Lewis PJ, Salama A. Uptake of fluorine-18-fluorodeoxy-glucose in sarcoidosis. J Nucl Med 1994;35:1647-9.
24. Cook CJ, Wegner EA, Fogelman I. Pitfalls and artifacts in 18FDG PET and PET/CT oncologic imaging. Semin Nucl Med 2004;34:122-33.
สุภัทรพร เทพมงคล พ.บ., รองศาสตราจารย์ สาขาเวชศาสตร์นิวเคลียร์ ภาควิชารังสีวิทยา,คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
- อ่าน 18,125 ครั้ง
 พิมพ์หน้านี้
พิมพ์หน้านี้




