NSAIDs เป็นยาที่มีการใช้และถูกสั่งโดยแพทย์แพร่หลายมากที่สุดขนานหนึ่ง มียอดจำหน่ายทั่วโลกประมาณปีละหมื่นล้านเหรียญสหรัฐ. NSAIDs มักใช้ในการรักษาอาการปวดและอักเสบของโรคกล้ามเนื้อและกระดูก มีคนประมาณ 30 ล้านคนในแต่ละวันที่จำเป็นต้องใช้และได้ประโยชน์จากการใช้ยา NSAIDs. เหตุที่มีการใช้ NSAIDs. เพิ่มขึ้นเรื่อยๆ มี หลายประการคือ 1) มีการใช้ยาขนานนี้ได้สะดวก มากขึ้นโดยไม่ต้องใช้ใบสั่งยา 2) มีประโยชน์จากการใช้ยา NSAIDs ในโรคหรือภาวะต่างๆ เพิ่มมากขึ้น และ 3) จำนวนประชากรสูงอายุมีมากขึ้น โดยร้อยละ 40 ของผู้ใช้ยา NSAIDs จะมีอายุมากกว่า 60 ปี. มีผู้ประมาณว่าในปี พ.ศ. 2568 โรคกระดูกและข้อเสื่อม จะเป็นสาเหตุที่พบบ่อยสุดของภาวะพิการทางร่างกาย อาจถึงร้อยละ 25 ของผู้ที่พิการหรือทุพพลภาพทั้งหมด ซึ่งจะก่อให้เกิดความเสียหายในด้านเศรษฐกิจและ สังคมอย่างมากและเพิ่มขึ้นทั่วโลก.1-3
อุบัติการณ์ของการเกิด gastrointestinal injury โดย NSAIDs2-4
NSAIDs ทำให้เกิดได้ทั้ง acute และ chronic injury โดยทำให้เกิดมีพยาธิสภาพได้ตลอด GI tract ตั้งแต่หลอดอาหารจนถึงลำไส้ใหญ่ส่วน rectum สำหรับตำแหน่งที่พบพยาธิสภาพได้บ่อยสุดคือ กระเพาะอาหารและลำไส้เล็กส่วนต้น. ถ้าผู้ป่วยกิน NSAIDs ระยะสั้นๆ (1-2 สัปดาห์) จะทำให้เกิดพยาธิสภาพ ได้แก่ mucosal erythema, submucosal hemorrhage และ superficial erosions ซึ่งพบได้ร้อยละ 60-100 ถ้ากิน NSAIDs ติดต่อกันนานกว่า 1 เดือน จะทำให้เกิดแผลในกระเพาะอาหาร และแผลในลำไส้เล็ก ได้ร้อยละ 15-30 โดยอัตราเสี่ยงของการเกิดแผลขึ้นอยู่กับขนาดของยาที่ใช้ ถ้าใช้ยาขนาดสูงมากยิ่งเกิดแผลได้มากและเกิดภาวะแทรกซ้อน เช่น เลือดออกในกระเพาะอาหารหรือมีแผลทะลุได้ร้อยละ 1-2. ผู้ป่วยที่ได้รับยา NSAIDs จะมีความเสี่ยงต่อการเกิดเลือดออกในกระเพาะอาหาร มากกว่าผู้ที่ไม่ได้รับยา NSAIDsถึง 4 เท่า ขอเน้นว่า NSAIDs ทุกตัวทำให้เกิด gastrointestinal injury รวมทั้ง selective Cox-2 inhibitors โดยมีอุบัติการณ์และความรุนแรงแปรตามสูตรยาที่ใช้เช่น COX-2 selectivity น้อย, half-life นาน หรือมี re-enterohepatic circulation จะทำให้เกิดพยาธิสภาพได้มากและรุนแรงกว่า แต่พยาธิสภาพ ที่เห็นนั้นไม่สามารถทำนายได้ว่าอัตราเสี่ยงที่จะเกิดแผล ตามมาหรือมีภาวะแทรกซ้อนเกิดขึ้นได้มากเพียงไร.
กลไกการเกิด NSAIDs-associated gastrointestinal injury5
นอกจากตัวยา NSAIDs เองมีฤทธิ์โดยตรงในการทำลายเยื่อบุกระเพาะอาหารและลำไส้เล็กส่วนต้นแล้ว กลไกที่สำคัญคือจะไปยับยั้งการสร้างฮอร์โมน prostaglandin ซึ่งมีบทบาทสำคัญในการสร้างความแข็งแรงและปกป้องเยื่อบุระบบทางเดินอาหารทั้งหมด ส่งผลให้ mucosal blood flow ลดลง, mucus secretion ลดลง, HCO3 secretion ลดลง และ cell restitution ลดลง ทำให้เยื่อบุทางเดินอาหารโดยเฉพาะบริเวณกระเพาะอาหารและลำไส้เล็กส่วนต้นได้รับอันตรายจากกรด pepsin และ NSAIDs ได้ง่าย เกิดการอักเสบขึ้นและนำไปสู่การเกิดแผล.
ผลเสียด้านระบบทางเดินอาหารอันเนื่องจาก NSAIDs
ผู้ป่วยที่กินยา NSAIDs จะมีอัตราเสี่ยงต่อการเกิดพยาธิสภาพในระบบทางเดินอาหารเพิ่มขึ้น 3-5 เท่า เมื่อเทียบกับผู้ที่ไม่ได้กินยา NSAIDs และอัตราเสี่ยงของการเกิดแผลในกระเพาะอาหารและแผลในลำไส้เล็กเป็น 5-15 เท่าเมื่อเทียบกับประชากรทั่วไป.6-9 อุบัติการณ์ของการเกิดภาวะแทรกซ้อน เช่นเลือดออกในกระเพาะอาหารหรือมีแผลทะลุ เป็นต้น พบได้ร้อยละ 2-4 ต่อปี และมีโอกาสเช่นนี้ไปตลอดตราบเท่าที่ยังกินยาอยู่.10 จากการศึกษาในผู้ป่วย 8,843 คนในประเทศสหรัฐอเมริกาและแคนาดา (MUCOSA Study).11 พบอุบัติการณ์ของภาวะแทรกซ้อนด้าน ระบบทางเดินอาหารเพียงร้อยละ 0.94 ส่วนภาวะแทรกซ้อนที่รุนแรงของหลอดอาหาร, ลำไส้เล็กและลำไส้ใหญ่พบได้ร้อยละ 1 อุบัติการณ์ของการเกิดแผลในกระเพาะอาหารและแผลในลำไส้เล็กโดยรวมของผู้กิน NSAIDs นาน 3-6 เดือน พบได้ร้อยละ 25 โดยพบเป็นแผลในกระเพาะอาหารร้อยละ 15 และแผลในลำไส้เล็กร้อยละ 10 ถ้าผู้ป่วยมีประวัติเป็น แผลในกระเพาะอาหารและแผลในลำไส้เล็กมาก่อน โอกาสที่จะเกิดแผลเพิ่มเป็นร้อยละ 50.12 สำหรับโอกาสที่จะเกิดภาวะแทรกซ้อนของแผลในกระเพาะอาหารและแผลในลำไส้เล็กมีเท่ากัน โดยทั่วไป aspirin จะมีศักยภาพทำให้เกิดเลือดออกมากกว่าเกิดแผล ส่วน non-aspirin NSAIDs จะทำให้เกิดแผลมากกว่าเลือดออก ซึ่งทั้ง 2 กลุ่มนี้จะมีอัตราตายเท่าๆ กันคือประมาณร้อยละ 10-15.
อัตราเสี่ยงของการเกิดเลือดออกในระบบทางเดินอาหารเนื่องจาก NSAIDs6
NSAIDs ทุกตัวรวมทั้ง selective COX-2 inhibitor สามารถทำให้เกิดพยาธิสภาพในระบบทางเดินอาหารมากหรือน้อยขึ้นอยู่กับคุณสมบัติของ NSAIDs แต่ละตัว และเป็น dose-related ดังแสดงในตารางที่ 1.
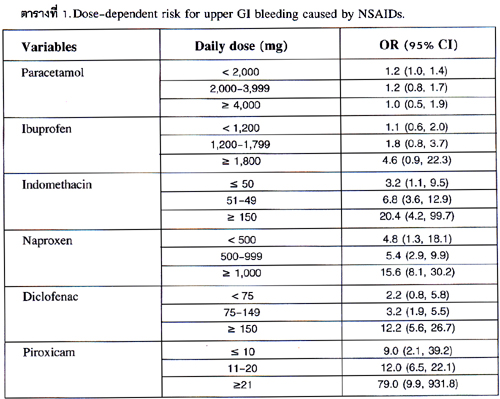
ตัวกำหนด (predictor) ที่จะบอกถึงผลของผู้ป่วยที่กินยา NSAIDs1-2,6-9
ในผู้ป่วยที่กินยา NSAIDs จะมีอาการ dyspepsia ได้ร้อยละ 20-60 การที่ผู้ป่วยมีอาการ dyspepsia จึงเป็นตัวกำหนดที่ไม่น่าเชื่อถือที่บอกถึงพยาธิสภาพ ที่เห็นโดยการส่องกล้องว่าจะเป็นอย่างไร. ขณะเดียวกันผู้ป่วยที่กินยา NSAIDs นาน จะพบมีพยาธิสภาพที่เยื่อบุกระเพาะอาหารโดยการส่องกล้องร้อยละ 67 ซึ่งทั้งอาการ dyspepsia และพยาธิสภาพที่เห็นจากการส่องกล้องจัดเป็นตัวกำหนดที่เชื่อถือไม่ได้ในการบอกว่าจะมีภาวะแทรกซ้อนที่รุนแรงจากการใช้ยา NSAIDs. จากการศึกษาของ Singh ในสหรัฐอเมริกาพบว่ามีภาวะแทรกซ้อนทางด้านระบบทางเดินอาหารที่รุนแรง (เช่น เลือดออก, แผลทะลุ) จากการกินยา NSAIDs ในผู้ป่วย rheumatoid arthritis 13 ต่อผู้ป่วย 1,000 คนต่อปี ในผู้ป่วยข้อเสื่อมพบ 7.3 ต่อ ผู้ป่วย 1,000 คนต่อปี โดยร้อยละ 81 ไม่พบว่ามีอาการ dyspepsia นำมาก่อน ซึ่งสิ่งนี้มีความสำคัญมากที่ชี้ให้เห็นว่าภาวะแทรกซ้อนรุนแรงของ NSAIDs เกิดโดยไม่มีอาการเตือนล่วงหน้า แพทย์จึงต้องมีความระมัดระวังอย่างมากในการสั่งใช้ยา NSAIDs.
จากการศึกษาโดยวิธี meta-analysis จำนวน 16 การศึกษา พบว่าผลเสียของ NSAIDs จะเกิดในช่วงใช้ยา 1 เดือนแรกเป็นส่วนใหญ่ (odd Ratio = 8) และลดลงเรื่อยๆจน plateau เมื่อเดือนที่ 4(odd Ratio = 2) ซึ่งยืนยันจากการสำรวจในประเทศเนเธอแลนด์พบว่าร้อยละ 74 ของผู้กินยา NSAIDs จะกินยาไม่เกิน 30 วัน และการศึกษาในสหรัฐอเมริกาในปี พ.ศ. 2540 พบว่า สาเหตุส่วนใหญ่ของผู้ป่วยเลือดออกในกระเพาะอาหารคือผู้ป่วยที่ซื้อยา NSAIDs กินเอง เป็นระยะเวลาสั้นๆ.
อายุเป็นปัจจัยเสี่ยงที่สำคัญอันหนึ่งในการเกิดภาวะแทรกซ้อนในระบบทางเดินอาหารจาก NSAIDs โดยอายุ 60-69 ปี มี relative risk = 3.1 อายุมากกว่า 70 ปี relative risk = 5.6 เมื่อเทียบกับอายุ 25-29 ปี มี relative risk = 1.0-1.6 เท่านั้น.
ปัจจัยเสี่ยงของการเกิดภาวะแทรกซ้อนจาก NSAIDs ต่อระบบทางเดินอาหาร11-14
a) ปัจจัยเสี่ยงสูงและเป็นที่ยอมรับแน่นอนแล้ว
1. อายุมากกว่า 60 ปี.
2. มีประวัติแผลในกระเพาะอาหารและแผลในลำไส้เล็กหรือประวัติเคยมีแผลที่มีภาวะแทรกซ้อน เช่น เลือดออกในกระเพาะอาหารหรือมีแผลทะลุ.
3. ใช้ยา NSAIDs ร่วมกับ corticosteroids.
4. ใช้ยา NSAIDs ในขนาดที่สูงกว่าปกติหรือใช้ยา NSAIDs มากกว่า 1 ตัวร่วมกัน.
5. ใช้ร่วมกับ anticoagulants.
6. มีโรคตามระบบอื่นๆ ที่รุนแรง.
b) ปัจจัยเสี่ยงที่อาจเป็นไปได้
1. มีการติดเชื้อ Helicobacter pylori ร่วมด้วย.
2. สูบบุหรี่.
3. ดื่มสุรา.
ความรุนแรงของแต่ละปัจจัยเสี่ยงแสดงในภาพที่ 1 จะเห็นได้ว่าปัจจัยเสี่ยงสูงสุดของการเกิดภาวะแทรกซ้อนในระบบทางเดินอาหารคือผู้ป่วยที่มีประวัติเป็นแผลในกระเพาะอาหารและเคยมีเลือดออกหรือมีแผลทะลุ (prior complicated ulcer) ซึ่งจะมีความเสี่ยงถึง 13.5 เท่า เมื่อเทียบกับผู้ป่วยที่เคยมีประวัติเป็นแผลในกระเพาะอาหารที่ไม่มีเลือดออกหรือแผลทะลุจะมีความเสี่ยงเพียง 6.1 เท่า ดังนั้น จึงมีความจำเป็นต้องซักประวัติให้ละเอียดว่าผู้ป่วยเคยมีประวัติเป็นแผลในกระเพาะอาหารแบบธรรมดา หรือเคยมีเลือดออกหรือมีแผลทะลุหรือไม่เพราะมีความเสี่ยงต่างกันมาก.
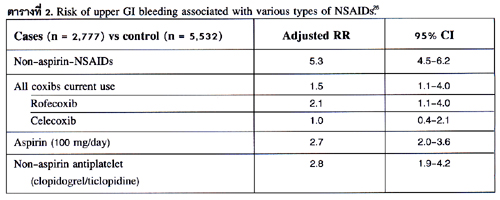
มาตรการในการป้องกันหรือลดความเสี่ยงเนื่องจาก NSAIDs
1. มาตรการทั่วไป15-16
1.1 เลือกใช้ short-acting NSAIDs หรือ NSAIDs ที่มีผลเสียต่อระบบทางเดินอาหารน้อยที่สุดเช่น Ibuprofen.
1.2 หลีกเลี่ยงการใช้ยา NSAIDs มากกว่า 1 ตัวในคราวเดียวกัน.
1.3 หลีกเลี่ยงการใช้ยา NSAIDs ร่วมกับ corticosteroid หรือ anticoagulant.
1.4 ให้ยา NSAIDs ในขนาดต่ำสุดและระยะเวลาที่ให้ NSAIDs ควรสั้นที่สุด.
1.5 เลือกใช้ยาแก้ปวดชนิดอื่นที่ไม่ใช่ NSAIDs.
2. การใช้ยา gastroprotective drugs เช่น Proton pump inhibitors (PPIs) หรือ Misoprostol ร่วมด้วย9,15-18
2.1 การใช้ยา PPIs ร่วมกับ NSAIDs ช่วยป้องกันการเกิด NSAIDs-induced ulcer ได้อย่าง มีนัยสำคัญทางสถิติ โดยจะป้องกันได้ทั้งแผลในกระเพาะอาหารและแผลในลำไส้เล็ก นอกจากนี้ยังป้องกันการเกิดซ้ำของภาวะแทรกซ้อนได้อีกด้วย ขนาดยา PPIs ที่ใช้คือขนาดยามาตรฐานของ PPIs ที่ใช้ทั่วไป.
2.2 การใช้ยา misoprostol ร่วมกับ NSAIDs จะช่วยป้องกันการเกิดแผลในกระเพาะอาหารได้ดี แต่การป้องกันแผลในลำไส้เล็ก จะมีประสิทธิภาพน้อยกว่า ขนาดที่ใช้คือ 200 ไมโครกรัม 3-4 ครั้ง ต่อวัน เนื่องจากยา misoprostol มีฤทธิ์ข้างเคียง เช่น ปวดท้อง, ท้องเสีย ที่พบได้บ่อยทำให้ความนิยมใช้ยาลดลง.
2.3 การใช้ยา H2RA ร่วมกับ NSAIDs จะช่วยป้องกันการเกิดแผลในลำไส้เล็ก แต่ไม่สามารถป้องกันการเกิดแผลในกระเพาะอาหาร ปัจจุบันจึงไม่นิยมใช้ยา H2RA ในการป้องกันแต่ใช้ยา PPIs แทน.
3. เลือกใช้ยา NSAIDs ตัวใหม่ที่มีความปลอดภัยมากขึ้น.19,20
เมื่อพิจารณาการกลไกของการออกฤทธิ์ของ NSAIDs พบว่า NSAIDs จะออกฤทธิ์ยับยั้งเอนไซม์ ทั้ง cyclooxygenase 1 (COX-1) และ cyclooxygenase-2 (COX-2). COX-1 เป็นเอนไซม์สำหรับการสร้าง prostaglandin ซึ่งมีหน้าที่ในการปกป้องเยื่อบุระบบทางเดินอาหารทั้งหมด และช่วยสนับสนุนการทำงานของ platelet และ renal homeostasis. สำหรับ COX-2 เป็นเอนไซม์ ที่สร้าง prostaglandin ซึ่งทำให้เกิดมีการอักเสบ อาการปวด และมีไข้. จากกลไกดังกล่าวเราต้องการ NSAIDs ที่ออกฤทธิ์ต่อ COX-2 อย่างเดียว และออกฤทธิ์ต่อ COX-1 น้อยมากหรือไม่มีผลเลย ซึ่งจะทำให้ NSAIDs ตัวนั้นมีฤทธิ์ในการต้านการอักเสบและลดอาการปวดโดยไม่มีผลเสียต่อระบบทางเดินอาหารและไต ในปัจจุบันมี NSAIDs ที่ปลอดภัยมากขึ้น และเป็นที่ต้องการดังนี้
3.1 Preferential inhibitor of COX-2 ได้แก่ nabumetone, etodolac และ meloxicam ยา NSAIDs ในกลุ่มนี้ออกฤทธิ์ยับยั้งทั้ง COX-1 และ COX-2 แต่ออกฤทธิ์ต่อ COX-2 มากกว่า. ข้อจำกัดของยากลุ่มนี้คือ ถ้าให้ในขนาดสูงขึ้น จะทำให้คุณสมบัติเปลี่ยนไปคือจะออกฤทธิ์ต่อ COX-1 มากขึ้นซึ่งเป็นสิ่งที่เราไม่ต้องการเนื่องจากจะทำให้เกิดภาวะแทรกซ้อนทางระบบทางเดินอาหารเพิ่มขึ้น.
3.2 Selective COX-2 inhibitor เช่น celecoxib, rofecoxib, parecoxib, valdecoxib, etoricoxib และ lumiracoxib ซึ่งเป็น NSAIDs กลุ่มใหม่ที่มีความปลอดภัยมากที่สุดในปัจจุบันโดยอุบัติการณ์ของผลเสียด้านระบบทางเดินอาหารของยานี้ใกล้เคียง placebo และน้อยกว่า NSAIDs ทั่วๆ ไป (non-selective NSAIDs) อย่างมีนัยสำคัญทางสถิติ21,22 และการใช้ยา selective COX-2 inhibitor นี้ไม่จำเป็นต้องให้ยา gastroprotective drugs ร่วมด้วย ยกเว้นการใช้ยา selective COX-2 inhibitor ใน ผู้ป่วยที่กำลังได้รับ aspirin22 หรือผู้ป่วยที่มีความเสี่ยงสูง23 เช่น เคยมีเลือดออกในทางเดินอาหารหรือ แผลกระเพาะทะลุมาก่อนจะมีความเสี่ยงของผลเสียด้านระบบทางเดินอาหารของยา selective COX-2 inhibitor ใกล้เคียงหรือเท่ากับ non-selective NSAIDs ดังนั้น ในกรณีดังกล่าวจำเป็นต้องให้ selective COX-2 inhibitor ร่วมกับ PPI ด้วยเสมอ.ในปัจจุบันผู้ป่วยที่มีความเสี่ยงสูง การป้องกันภาวะเลือดออกซ้ำในทางเดินอาหารจากแผลในกระเพาะอาหารที่ดีที่สุดคือ การให้ selective COX-2 inhi-bitor ร่วมกับ PPI โดยไม่ต้องคำนึงว่าผู้ป่วยนั้นได้รับ aspirin ร่วมด้วยหรือไม่ จะป้องกัน recurrent ulcer bleeding ได้ดีกว่าการให้ selective COX-2 inhibitor อย่างเดียว อย่างมีนัยสำคัญทางสถิติ.24
3.3 NSAIDs containing nitric oxide (NO-NSAIDs) โดยฤทธิ์ของ nitric oxide จะเข้ามาทดแทนฤทธิ์ของ prostaglandin ซึ่งถูกยับยั้งการสร้างโดย NSAIDs ผ่านทาง COX-1 nitric oxide จะทำให้ mucosal blood flow เพิ่มขึ้น, mucus secretion เพิ่มขึ้น, HCO3- secretion เพิ่มขึ้น และ cell restitution เพิ่มขึ้น ซึ่งจะเป็นการเสริมสร้างความแข็งแรงและปกป้องเยื่อบุระบบทางเดินอาหาร นอกจากนี้ nitric oxide ยังมีฤทธิ์ยับยั้ง neutrophil adherence ต่อ endothelium ของหลอดเลือดที่เยื่อบุระบบทางเดินอาหาร ทำให้โอกาสเกิดการอักเสบลดลงอย่างมาก (ปัจจุบันยานี้ยังอยู่ในขั้นการศึกษาทดลอง).
มาตรการในการป้องกันความเสี่ยงเนื่องจาก NSAIDs โดยเฉพาะ aspirin
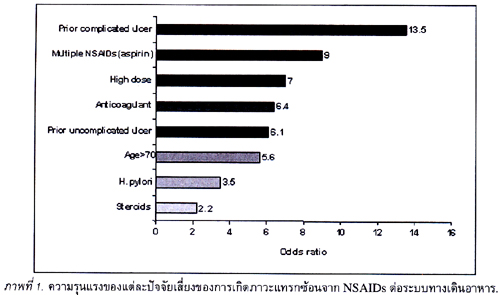
ผู้ป่วยที่ได้รับ aspirin จะทำให้มีความเสี่ยงของภาวะเลือดออกจากแผลในกระเพาะอาหารมีเพิ่มขึ้นอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับกลุ่มที่ไม่ได้รับยา aspirin และเป็น dose-related25 กล่าวคือผู้ป่วยที่ได้รับ aspirin ชนิดธรรมดา ขนาด 75 มก. จะมีความเสี่ยงเพิ่มขึ้น 2.3 เท่า ถ้าเพิ่มเป็น 150 มก. และ 300 มก. ความเสี่ยงจะเพิ่มเป็น 3.2 และ 3.9 เท่าตามลำดับ. แม้การใช้ enteric-coated aspirin ความเสี่ยงยังเพิ่มเป็น 2.7 เท่า จากการศึกษาของ Lanas ซึ่งเป็น case-control study ประมาณ 8,000 คน26 (ตารางที่ 2)
พบว่า aspirin 100 มก. มีความเสี่ยงของภาวะเลือดออกจากแผลในกระเพาะอาหารเพิ่มขึ้น 2.7 เท่า เมื่อเปรียบเทียบกับ non-aspirin NSAIDs เพิ่มขึ้น 5.3 เท่า selective COX-2 inhi-bitor เพิ่มขึ้น 1.5 เท่า และ non-aspirin antiplatelet เช่น clopidogrel มีความเสี่ยงเพิ่มขึ้น 2.8 ซึ่งไม่แตกต่างจาก aspirin 100 มก.
การป้องกันผลเสียของ aspirin ต่อระบบทาง เดินอาหารใช้แนวทางในการป้องกันเช่นเดียวกับการป้องกันผลเสียจาก NSAIDs ทั่วๆ ไปคือ ผู้ที่ได้รับยา aspirin ที่มีความเสี่ยงสูงจะต้องได้รับยา PPI ร่วมด้วย เสมอ. มีการศึกษาล่าสุดของ Yeomans27 ในผู้ป่วยที่มีความเสี่ยงและจำเป็นต้องได้รับ low dose aspirin (75-325 มก./วัน) โดยเปรียบเทียบผู้ป่วย ที่ได้รับ aspirin ร่วมกับ PPI หรือร่วมกับ placebo พบว่ากลุ่มที่ได้ PPI จะสามารถป้องกันการเกิดทั้งแผลในกระเพาะอาหารและแผลในลำไส้เล็กได้อย่างมีประสิทธิภาพเมื่อเปรียบเทียบกับกลุ่มที่ให้ placebo โดย PPI สามารถทำให้ความเสี่ยงของการเกิดแผลลดลงร้อยละ 70.
สำหรับผู้ป่วย stroke หรือ ischemic heart disease ที่ได้รับ aspirin เป็น secondary prophylaxis แล้วเกิดมีภาวะเลือดออกจากแผลในกระเพาะอาหาร เมื่อต้องกลับมาใช้ aspirin ใหม่จะทำให้มีความเสี่ยงต่อภาวะเลือดออกจากแผลในกระเพาะอาหารเพิ่มขึ้น การเปลี่ยนไปใช้ antiplatelet ชนิดอื่นที่ไม่ใช่ aspirin เช่น clopidogrel จะเป็นผลดีต่อผู้ป่วยหรือไม่. จากการศึกษาของ Chan28 พบว่ากลุ่มที่ได้ aspirin เช่นเดิมร่วมกับ PPI จะมีภาวะเลือดออกซ้ำจากแผลในกระเพาะอาหารน้อยกว่ากลุ่มที่เปลี่ยนไปใช้ clopidogrel เพียงอย่างเดียวอย่างมีนัยสำคัญทางสถิติ. การศึกษานี้แสดงให้เห็นว่าการเปลี่ยน antiplatelet จาก aspirin ไปเป็น clopidogrel ไม่ได้ทำให้ความเสี่ยงของภาวะเลือดออกจากแผลในกระเพาะอาหารลดลง แต่การให้ PPI ร่วมกับ aspirin ในผู้ป่วยที่มีความเสี่ยงสูงจะสามารถลดความเสี่ยงของภาวะเลือดออกซ้ำจากแผลในกระเพาะอาหารได้อย่างชัดเจน.
แนวทางในการป้องกันการเกิด NSAIDs- induced GI injury
เนื่องจากผู้ป่วยที่ได้รับ NSAIDs ทุกรายมีส่วนน้อยที่จะเกิดภาวะแทรกซ้อนด้านระบบทางเดินอาหาร ที่มีความสำคัญทางคลินิก จึงไม่มีความจำเป็นที่จะต้องให้การป้องกันในผู้ป่วยที่ได้รับยา NSAIDs ทุกราย. จากการประชุม Sardinia Consensus29 แนะนำให้มีการประเมินความเสี่ยงของผู้ป่วยที่จะได้รับยา NSAIDs ก่อนเสมอ ถ้าผู้ป่วยนั้นได้รับการประเมินแล้วว่าเป็นผู้ป่วยในกลุ่มที่มีปัจจัยเสี่ยงสูง ควรได้รับยา PPIs หรือ Misoprostol ร่วมด้วย หรืออาจเลือกใช้ยา selective COX-2 inhibitor แทนก็ได้โดยไม่ต้องใช้ยา gastroprotective drug ในการป้องกัน ถ้าประเมินแล้วว่าเป็นผู้ป่วยในกลุ่มที่มีปัจจัยเสี่ยงต่ำไม่จำเป็นต้องให้การป้องกันใดๆ ดังแสดงในภาพที่ 2.
การประเมินความเสี่ยงเพื่อป้องกันการเกิดภาวะแทรกซ้อนจาก NSAIDs
การใช้ selective COX-2 inhibitor จะช่วยเพิ่ม ความปลอดภัยต่อระบบทางเดินอาหารขึ้นมาก โดยลดผลเสียต่อระบบทางเดินอาหารได้อย่างมากเมื่อเทียบกับ non-selective NSAIDs ต่อมามีหลักฐานยืนยันว่า selective COX-2 inhibitor ทำให้เกิดผลเสียต่อระบบหัวใจและหลอดเลือดโดยทำให้มีความเสี่ยงของการเกิดกล้ามเนื้อหัวใจขาดเลือดเพิ่มขึ้น 2.4 เท่า และการให้ aspirin ร่วมด้วยไม่สามารถลด ความเสี่ยงต่อการเกิดกล้ามเนื้อหัวใจขาดเลือดได้30 ดังนั้น การประเมินความเสี่ยงของการใช้ยา NSAIDs จะต้องประเมินทั้งความเสี่ยงต่อการเกิดผลเสียด้านระบบทางเดินอาหารและความเสี่ยงต่อการเกิดผลเสียด้านระบบหัวใจและหลอดเลือด ดังแสดงในตารางที่ 3.
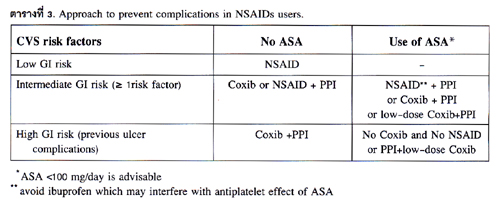
ในแนวทางการป้องกันภาวะแทรกซ้อนจาก NSAIDs ที่แนะนำโดย Scheiman31 และ Lanas32 ให้ประเมินว่ามีความเสี่ยงต่อการเกิดผลเสียด้านระบบหัวใจและหลอดเลือด (CVS risk) โดยผู้ป่วยที่ได้รับ aspirin ถือว่ามี CVS risk. สำหรับการประเมินว่ามีความเสี่ยงต่อการเกิดผลเสียด้านระบบทางเดินอาหาร (GI risk) ให้แบ่งเป็น 3 ระดับได้แก่ low GI risk คือไม่มีปัจจัยเสี่ยงของการเกิด GI ภาวะแทรกซ้อน จาก NSAIDs ทั้ง 6 ข้อดังกล่าวแล้ว. สำหรับ intermediate GI risk คือมีปัจจัยเสี่ยงข้อใดข้อหนึ่งหรือมีมากกว่า 1 ข้อ แต่ต้องไม่ใช่ข้อที่มี previous ulcer ภาวะแทรกซ้อน ถ้ามี previous ulcer complication เพียงข้อเดียวถือเป็น high GI risk.
ถ้าเป็น low GI risk และไม่มี CVS risk สามารถใช้ยา non-selective NSAID ตัวใดก็ได้โดยไม่ต้องให้ยา PPI ในการป้องกัน ถ้าเป็น intermediate GI risk แต่ไม่มี CVS risk แนะนำให้ใช้ non-selective NSAID+PPI หรือใช้ selective COX-2 inhibitor ตัวเดียวถือว่าปลอดภัย. ในกรณีเป็น intermediate GI risk และมี CVS risk (ได้ aspirin) ห้ามให้ selective Cox-2 inhibitor ตัวเดียว เพราะจะไม่ปลอดภัยต้องใช้ selective COX-2 inhibitor (usual dose หรือ low dose) ร่วมกับ PPI หรือใช้ non-selective NSAID ร่วมกับ PPI โดยมีข้อแนะว่าไม่ควรใช้ Ibuprofen เพราะจะไปรบกวน anti-platelet effect ของ aspirin ในกรณีนี้แนะนำให้ใช้ naproxen ซึ่งจะไม่มีผลต่อ anti-palate effect ของ aspirin ในกรณีเป็น high GI risk แต่ไม่มี CVS risk แนะนำให้ใช้ selective COX-2 inhibitor ร่วมกับ PPI ถือว่าปลอดภัยสุด ถ้ามี CVS risk ด้วยแนะนำว่าไม่ควรใช้ NSAIDs เลย ไม่ว่าเป็น selective COX-2 inhibitor หรือ non-selective NSAID เพราะว่ามีความเสี่ยงสูงมาก ถ้าจำเป็นต้องใช้แนะนำให้ใช้ low-dose selective COX-2 inhibitor ร่วมกับ PPI สำหรับขนาดยา PPI ที่ใช้ในการป้องกันนั้นใช้ standard dose ของ PPI แต่ละตัว วันละครั้งก่อนอาหารเช้าและระยะเวลาที่ให้คือให้นานเท่ากับระยะเวลาที่ผู้ป่วยได้รับNSAIDs.
แนวทางในการรักษาผู้ป่วยที่กำลังได้รับยา NSAIDs และมีอาการ dyspepsia เกิดขึ้น29
เมื่อเกิดอาการ dyspepsia ในผู้ป่วยที่กำลังได้รับยา NSAIDs พบว่าโอกาสที่จะเป็น NSAIDs-induced ulcer จะมากกว่าผู้ที่ไม่มีอาการ dyspepsia เพียงเล็กน้อย (strength of support ระดับ 3 และ level of evidence ระดับ 3) แนวทางในการดูแลรักษาว่าจะหยุดยาหรือไม่ หรือควรจะไปทำการสืบค้นเลยให้ปฏิบัติตามแนวทางดังแสดงในภาพที่ 3 โดยตรวจ หาว่าผู้ป่วยนี้มีเลือดออก, ซีด หรือมีน้ำหนักตัวลดลงหรือไม่ ถ้าไม่มีแนะนำให้หยุดยา NSAIDs ถ้าหยุดยา NSAID ไม่ได้ ทางเลี่ยงคือให้ PPI ร่วมกับ NSAID หรือเปลี่ยนเป็นใช้ยา selective COX-2 inhibitor แทน ถ้ายังมีอาการ dyspepsia อยู่ให้ลดขนาดของ selective COX-2 inhibitor หรือให้ PPI ร่วมกับ selective COX-2 inhibitor สุดท้ายถ้ายังมีอาการ dyspepsia แนะนำให้ส่องกล้องตรวจดูกระเพาะอาหารว่ามีพยาธิสภาพเป็นอย่างไร.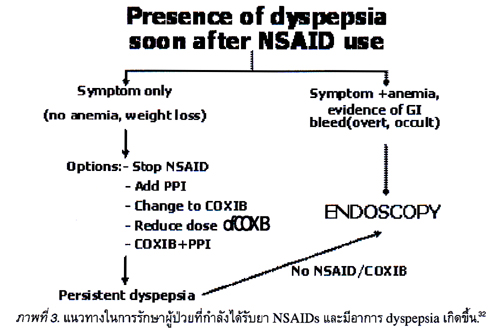
แนวทางในการรักษาผู้ป่วย NSAIDs-induced ulcer16,29
ลักษณะของ NSAIDs-induced ulcer จะมีความแตกต่างจากแผลที่เกิดจากสาเหตุอื่น เช่น แผลจะหายยากกว่าแผลทั่วๆ ไป โดยเฉพาะถ้าผู้ป่วยที่ไม่สามารถหยุดยา NSAIDs ได้ และเมื่อแผลหายแล้วจะมีอัตราเกิดเป็นแผลซ้ำสูง ที่สำคัญคือ NSAIDs-induced ulcer จะเกิดภาวะแทรกซ้อนเช่นเลือดออกหรือทะลุโดยที่จะไม่มีอาการนำมาก่อนเลย (asymptomatic) แนวทางในการรักษาผู้ป่วย NSAIDs-induced ulcer เป็นดังนี้
1. ในกรณีที่ผู้ป่วยหยุดยา NSAIDs ได้ การรักษาด้วย H2RA หรือ PPIs มีประสิทธิภาพในการทำให้แผลหายใกล้เคียงกัน.
2. ในกรณีที่ผู้ป่วยจำเป็นต้องให้ยา NSAIDs ต่อไป การรักษาที่ดีที่สุด (drugs of choice) คือ PPIs.
3. ถ้าผู้ป่วยมีการติดเชื้อ Helicobacter pylori ร่วมด้วย แนะนำให้การรักษาเพื่อกำจัดเชื้อ elicobacter pylori ด้วย.
เอกสารอ้างอิง
1. Griffin MR. Epidemiology of NSAID-associated gastrointestinal injury. Am J Med 1998; 104(3A):23S-9S.
2. Singh G, Triadafilopoulos G. Epidemiology of NSAID-induced GI complications. J Rheumatol 1999; 26(Suppl):18-24.
3. Straus WL, Ofman JJ. Gastrointestinal toxicity associated with NSAIDs : epidemiology and economic issues. Gastroenterol Clin N Am 2001; 30:895-919.
4. Cheatum DE, Arvanatikis C, Gumpel M, Stead H, Geis SG. An endoscopic study of gastroduodenal lesions induced by NSAIDs. Clin Ther 1999; 21:992-1003.
5. Vane JR, Botting RM. Mechanism of action of NSAIDs. Am J Med 1998;104(3A):2S-8S.
6. Lewis SC, et al. Dose-response relationships between individual nonaspirin nonsteroidal anti-inflammatory drugs (NANSAIDs) and serious upper gastrointestinal bleeding : a meta-analysis based on individual patient data Br J Cli Pharmacol 2002; 54:320-6.
7. Davies NM, Wallace JL. NSAID induced gastrointestinal toxicity : new insights into an old problems. J Gastroenterol 1997; 32:127-33.
8. Geis GS. Prevalence of mucosal lesions in the stomach and duodenum due to chronic use of NSAIDs in patients with rheumatoid arthritis or osteoarthritis. J Rheumatol 1991; 18(Suppl 28):11-4.
9. Goldstein JL. Who needs prophylaxis of NSAID-induced ulcer and what is optimal prophylaxis? Eur J Gastroenterol Hepatol 2000; 12(Suppl1):S11-S6.
10. Singh G, Rosen Ramey D. NSAID induced gastrointestinal complications: the ARAMIS perspective-1997. Arthritis, Rheumatism and Aging Medical Information System. J Rheumatol Suupl 1998; 51:8-16.
11. Silverstein FE, Graham DY, Senior JR, et al. Misoprostol reduces serious gastrointestinal complications in patients with rheumatoid arthritis receiving NSAIDs. A randomized double-blind, placebo controlled trial (MUCOSA trial). Ann Intern Med 1995; 123:241-9.
12. Simon LS, Hatoum HT, Bittman RM, et al. Risk factors for serious non-steroidal induced gastrointestinal complications : regression analysis of the MUSOCA trial. Family Med 1996; 28:204-10.
13. Hansen JM, Hallas J, Lauitsen JM, Bytzer P. NSAIDs and ulcer complications : a risk factor analysis for clinical decision making. Scand J Gastroenterol 1996; 31:126-30.
14. Fries JF. Identification of patients at risk for gastropathy associated with NSAID use. J Rheumatol 1990; 17(Suppl 20):12-9.
15. Hawkey CJ. Progress in prophylaxis against NSAID-associated ulcers and erosions. Am J Med 1998; 104(3A):67S-74S.
16. Yeomans ND. Approaches to healing and prophylaxis of NSAIDs-associated ulcers. Am J Med 2001; 110(1A):24S-8S.
17. Hawkey CJ, Karrasch JA, Szczepanski L, et al. Omeprazole compared with misoprostol for ulcers associated with NSAIDs. Omeprazole versus Misoprostol for NSAID-induced ulcer Management (OMNIUM) Study Group. N Engl J Med 1998; 338:727-34.
18. Yeomans ND, Tulassay Z, Juhasz L, et al. for the Acid Suppression Trial: Ranitidine versus Omeprazole for NSAID-Associated Ulcer Treatment (ASTRONAUT) Study Group. A comparison of omeprazole with ranitidine for ulcer associated with NSAIDs. N Engl J Med 1998; 338:719-26.
19. Lefkowith JB. Cyclooxygenase-2 specificity and its clinical implications. Am J Med 1999; 106(5B):43S-50S.
20. Schoenfeld P. An evidence-based approach to the GI safety profile of COX-2 selective anti-inflammations. Gastroenterol Clin N Am 2001; 30:1027-44.
21. Bombardier C, Laine L, Reicin A, et al. Comparisons of Upper Gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. N Engl J Med 2000; 343:1520-8.
22. Silverstein FE, Faich G, Goldstein J, et al. Gastrointestinal toxicity with celecoxib vs NSAIDs for osteoarthritis and rheumatoid arthritis;the Class study. A randomized controlled trial-Celecoxib Long-term Arthritis Safety Study. JAMA 2000; 284:1247-55.
23. Chan FKL.et al. Celecoxib Versus Diclofenac Plus Omeprazole in High-Risk Arthritis Patients: Results of a Randomized Double-Blind Trial. Gastroenterolol 2004; 127:1038-43.
24. Chan FKL. Et al. Combination of a cyclo-oxygenase-2 inhibitor and a proton-pump inhibitor for prevention of recurrent ulcer bleeding in patients at very high risk: a double-blind, randomised trial. Lancet 2007; 369:1621-6.
25. Weil J, et al. Prophylactic aspirin and risk of peptic ulcer bleeding. BMJ 1995; 310:827-30.
26. Lanas A, et al. Risk of upper gastrointestinal ulcer bleeding associated with selective cyclo-oxygenase-2 inhibitors, traditional non-aspirin non-steroidal anti-inflammatory drugs, aspirin and combinations. Gut 2006; 55:1731-8.
27. Yeomans N, et al. Efficacy of Esomeprazole (20 mg Once Daily) for Reducing the Risk of Gastroduodenal Ulcers Associated With Continuous Use of Low-Dose Aspirin. Am J Gastroenterol 2008; 103:2465-73.
28. Chan FKL, et al. Clopidogrel versus Aspirin and Esomeprazole to Prevent Recurrent Ulcer Bleeding. N Engl J Med 2005; 352:238-44.
29. Hawkey CJ, Lanas AI, on behalf of the Sardinia NSAID meeting participants. Doubt and certainty about NSAIDs in the year 2000 : A multidisciplinary Expert Statement. Am J Med 2001: 110(1A):79S-100S.
30. Solomon SD. Cardiovascular Risk Associated with Celecoxib in a Clinical Trial for Colorectal Adenoma Prevention. N Engl J Med 2005; 352:1071-80.
31. Scheiman JM. Prevention of NSAID-Induced Ulcers. Curr Treat Options Gastroenterol 2008, 11:125-34.
32. Lanas A. NSAID-induced gastrointestinal damage : Current clinical management and recommendations for prevention. Chinese Journal of Digestive Diseases 2006; 7:127-33.
อุดม คชินทร พ.บ., ศาสตราจารย์คลินิก
สาขาวิชาโรคระบบทางเดินอาหาร ภาควิชาอายุรศาสตร์
คณะแพทยศาสตร์ศิริราชพยาบาล มหาวิทยาลัยมหิดล
- อ่าน 28,723 ครั้ง
 พิมพ์หน้านี้
พิมพ์หน้านี้




